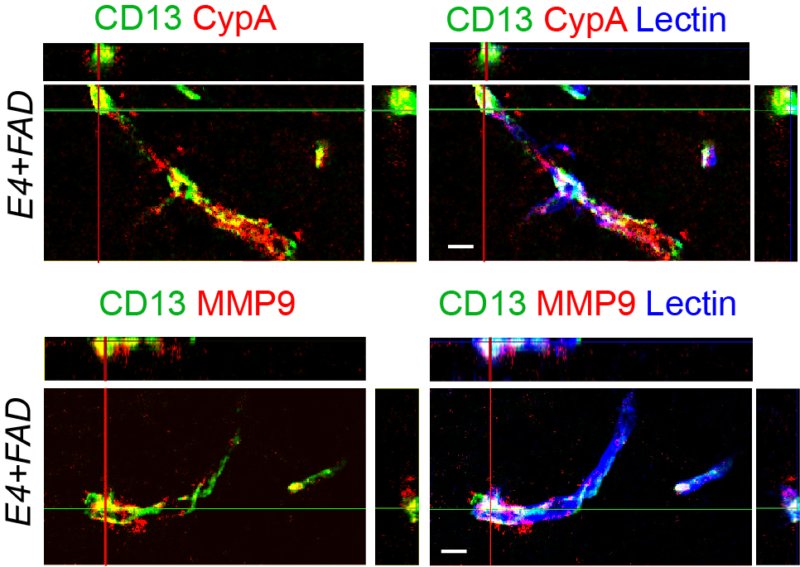
 Attivazione della ciclofilina A (CypA; in rosso pannelli sopra) porta all'attivazione di MMP9 (in rosso pannelli sotto) in periciti CD13 (verde) nei capillari cerebrali di topo con Alzheimer con amiloide-beta avanzata. Le immagini sulla destra, perpendicolare a quelle di sinistra, mostrano una sovrapposizione di CYPA o MMP9 con periciti CD13; lectina dell'endotelio è colorata blu indica i capillari corticali. (Fonte: Angeliki Nikolakopoulou PhD)
Attivazione della ciclofilina A (CypA; in rosso pannelli sopra) porta all'attivazione di MMP9 (in rosso pannelli sotto) in periciti CD13 (verde) nei capillari cerebrali di topo con Alzheimer con amiloide-beta avanzata. Le immagini sulla destra, perpendicolare a quelle di sinistra, mostrano una sovrapposizione di CYPA o MMP9 con periciti CD13; lectina dell'endotelio è colorata blu indica i capillari corticali. (Fonte: Angeliki Nikolakopoulou PhD)
|
Come la placca amiloide, la variante genetica APOE4 è da tempo associata al morbo di Alzheimer (MA), ma è ancora poco noto del ruolo del gene nel processo della malattia.
Il ruolo di APOE4, periciti e ciclofilina A nel MAL'APOE4 ha dimostrato di accelerare la rottura della barriera emato-encefalica danneggiando i periciti, uno strato di cellule che rafforzano e proteggono i capillari cerebrali che costituiscono la barriera. Questa rottura è associata anche a livelli più elevati di ciclofilina A, una proteina pro-infiammatoria, nei vasi cerebrali dei pazienti con MA e con gene APOE4.
|
Fonte: Materials provided by University of Southern California (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Axel Montagne, Angeliki Nikolakopoulou, Mikko Huuskonen, Abhay Sagare, Erica Lawson, Divna Lazic, Sanket Rege, Alexandra Grond, Edward Zuniga, Samuel Barnes, Jacob Prince, Meghana Sagare, Ching-Ju Hsu, Mary LaDu, Russell Jacobs, Berislav Zlokovic. APOE4 accelerates advanced-stage vascular and neurodegenerative disorder in old Alzheimer’s mice via cyclophilin A independently of amyloid-β. Nature Aging, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV