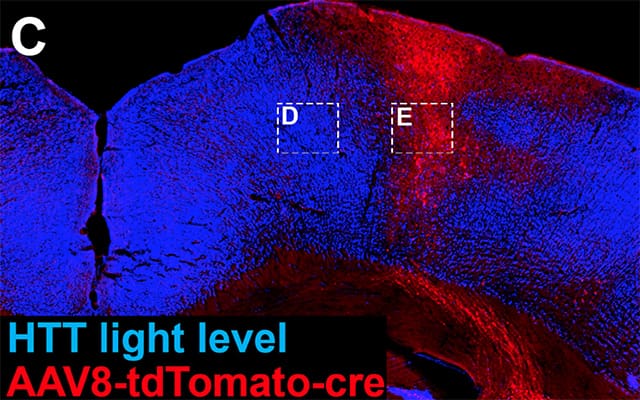
 Sezione trasversale del cervello di topo con cellule (blu) che esprimono livelli normali del gene huntingtina mentre alle cellule rosse è stato tolto il gene, e hanno meno rigenerazione.
Sezione trasversale del cervello di topo con cellule (blu) che esprimono livelli normali del gene huntingtina mentre alle cellule rosse è stato tolto il gene, e hanno meno rigenerazione.
Quando le cellule cerebrali adulte sono ferite, ritornano ad uno stato embrionale, secondo nuovi risultati pubblicati il 15 aprile 2020 su Nature da ricercatori della University of California San Diego, con colleghi di altre istituzioni. Gli scienziati riferiscono che, nel loro stato immaturo appena adottato, le cellule riescono a far ri-crescere nuove connessioni che, nelle giuste condizioni, possono aiutare a ripristinare la funzione persa.
Riparare i danni al cervello e al midollo spinale può essere la sfida più scoraggiante della scienza medica. Fino a tempi relativamente recenti, sembrava un compito impossibile. Il nuovo studio delinea una “tabella di marcia trascrizionale della rigenerazione nel cervello adulto”.
“Usando gli strumenti incredibili delle moderne neuroscienze, la genetica molecolare, la virologia e la potenza di calcolo, siamo riusciti per la prima volta a identificare come l'intero set di geni della cellula di un cervello adulto si resetta al fine di rigenerarsi. Questo ci dà una visione fondamentale sul modo in cui avviene la rigenerazione, a livello trascrizionale“, ha detto l'autore senior Mark Tuszynski MD/PhD, professore di neuroscienze e direttore del Translational Neuroscience Institute della UC San Diego.
Utilizzando un topo modello, Tuszynski e i colleghi hanno scoperto che dopo un infortunio, neuroni maturi nel cervello adulto tornano a uno stato embrionale. “Chi l'avrebbe mai pensato!”, ha detto Tuszynski. “Solo 20 anni fa, pensavamo ancora al cervello adulto come statico, terminalmente differenziato, completamente assodato e immutabile”.
Ma il lavoro di Fred “Rusty” Gage PhD, presidente e professore dell'Istituto Salk per gli studi biologici e professore a contratto alla UC San Diego, e di altri ricercatori, ha trovato che vengono continuamente prodotte nuove cellule cerebrali nell'ippocampo e nella zona subventricolare, reintegrando queste regioni del cervello per tutta la vita.
“Il nostro lavoro radicalizza ulteriormente questo concetto”, ha detto Tuszynski. “La capacità del cervello di auto-ripararsi o auto-sostituirsi non è limitata a due sole aree. Al contrario, quando una cellula della corteccia del cervello adulto è ferita, ritorna (a livello trascrizionale) a neurone corticale embrionale. E in questo stato regredito e molto meno maturo, può far ricrescere gli assoni, se c'è un ambiente in cui crescere. A mio parere, questa è la caratteristica più notevole dello studio ed è decisamente scioccante“.
Per fornire un “ambiente incoraggiante per la ricrescita” Tuszynski e colleghi hanno studiato come i neuroni danneggiati rispondono dopo una lesione del midollo spinale. Negli ultimi anni, i ricercatori sono andati notevolmente avanti con la possibilità di usare le cellule staminali neurali trapiantate per stimolare la riparazione delle lesioni del midollo spinale e ripristinare la funzione persa; in sostanza, inducendo i neuroni ad estendere gli assoni attraverso un sito di lesione, ricollegando i nervi mozzati.
L'anno scorso, per esempio, un team multidisciplinare guidato da Kobi Koffler PhD, assistente professore di neuroscienze, Tuszynski e Shaochen Chen PhD, professore di nanoingegneria e membro di facoltà all'Istituto di Ingegneria in Medicina alla UC San Diego, hanno descritto l'uso di impianti stampati in 3D per promuovere la crescita delle cellule nervose nelle lesioni del midollo spinale dei ratti, ripristinando le connessioni e le funzioni perse.
L'ultimo studio ha prodotto una seconda sorpresa: nel promuovere la crescita e la riparazione dei neuroni, uno dei percorsi genetici essenziali coinvolge il gene huntingtina (HTT), che, se mutato, causa la malattia di Huntington, una malattia devastante caratterizzata dalla progressiva rottura delle cellule nervose il cervello.
La squadra di Tuszynski ha scoperto che il “trascrittoma rigenerativo” (la raccolta di molecole di RNA messaggero usata dai neuroni cortico-spinali) è sostenuto dal gene HTT. Nei topi geneticamente modificati per mancare del gene HTT, le lesioni del midollo spinale hanno mostrato una carenza significativa di germinazione neuronale e rigenerazione.
“Mentre è stato fatto molto lavoro per cercare di capire perché le mutazioni dell'huntingtina causano la malattia, sappiamo molto meno sul ruolo normale dell'huntingtina”, ha detto Tuszynski. “Il nostro lavoro mostra che l'huntingtina è essenziale per promuovere la riparazione dei neuroni del cervello. Perciò le mutazioni in questo gene potrebbero determinare l'impossibilità del neurone adulto di riparare se stesso. Questo, a sua volta, potrebbe comportare la degenerazione neuronale lenta che si traduce in malattia di Huntington”.
Fonte: Scott LaFee in University of California - San Diego (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Gunnar Poplawski, Riki Kawaguchi, Erna Van Niekerk, Paul Lu, Neil Mehta, Philip Canete, Richard Lie, Ioannis Dragatsis, Jessica Meves, Binhai Zheng, Giovanni Coppola, Mark Tuszynski. Injured adult neurons regress to an embryonic transcriptional growth state. Nature, 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV