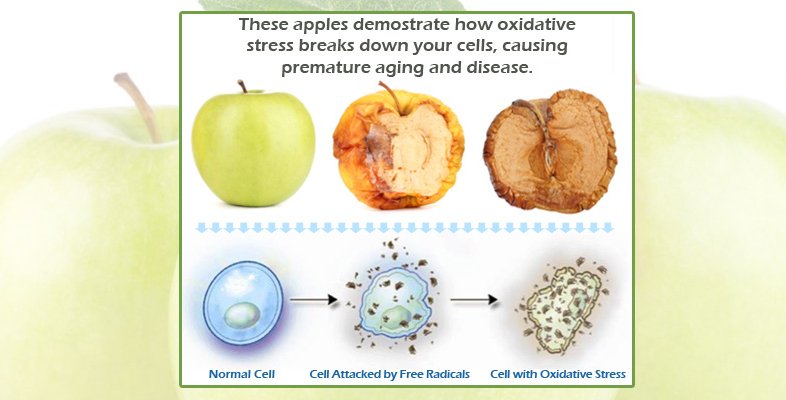
Un team internazionale di ricercatori ha scoperto di recente un meccanismo interno che può proteggere le cellule umane dal danno ossidativo. La scoperta potrebbe portare a progressi nella comprensione di molti problemi connessi con l'invecchiamento e con alcune malattie croniche.
Ed Schmidt, professore del Dipartimento di Microbiologia e Immunologia della Montana State University, ha lavorato sul progetto con gruppi di ricerca di Ungheria, Svezia e Giappone, e ha pubblicato le conclusioni sulla rivista Science Advances.
Il meccanismo, ha detto Schmidt, è uno strumento in precedenza sconosciuto che le cellule possono usare per impedire alle loro proteine di essere danneggiate irreversibilmente da processi cellulari chiamati 'reazioni redox', che sono comuni e necessari, ma che, se sono in eccesso, possono causare danni gravi.
“Le reazioni redox sono tutte le reazioni in cui si trasferiscono elettroni da una molecola all'altra”, ha detto Schmidt. “Quasi tutto quello che succede nelle nostre cellule, chimicamente ed energicamente, comporta il trasferimento di elettroni. Ma è fondamentale che questi siano tenuti in equilibrio. Le nostre cellule investono una quantità enorme di energia e di macchinari per mantenere corretto l'equilibrio redox“.
La scoperta fatta dal team di Schmidt riguarda gli atomi di zolfo, nell'ambito delle molecole proteiche all'interno delle cellule. Quando le cellule sono esposte a fattori esterni di stress (dal cibo assunto, ai prodotti chimici a cui sono esposte le cellule o a una qualsiasi delle altre fonti), quello stress ossidativo può danneggiare parti delle proteine.
In passato si pensava che le cellule non avessero alcun modo per invertire tale ossidazione, affidandosi invece alla produzione di nuove proteine per sostituire quelle danneggiate. Tuttavia, ha detto Schmidt, sembra che le nostre cellule siano a volte in grado di proteggere se stesse aggiungendo un atomo extra di zolfo, oltre a quelli presenti in alcune molecole proteiche. Poi, quando la cellula è sottoposta a stress, solo quello zolfo in più è danneggiato e può quindi essere espulso dalla cellula, lasciando dietro una proteina intera e non danneggiata.
“Abbiamo il sospetto che una volta che l'esposizione inizia, per la cellula è troppo tardi attuare questo processo”, ha detto Schmidt. “Pensiamo che le cellule abbiano un sottoinsieme di proteine già in questo stato, con atomi extra di zolfo, il che le rende probabilmente inattive, ma come riserva. Queste proteine di riserva sono danneggiate, ma possono essere riparate e permettono alla cellula di iniziare il recupero per produrre nuove proteine”.
Un danno ossidativo estremo può causare mutazioni del DNA, ha detto Schmidt. Quando queste mutazioni si accumulano, ci sono alcune evidenze che puntano a un aumento del rischio di tumori, malattie infiammatorie, Parkinson, Alzheimer e diabete. Questa nuova scoperta potrebbe favorire progressi nella medicina, contribuendo a prevedere o addirittura a limitare tali problemi di salute, se le cellule umane possono usare questo meccanismo in modo più efficiente, ha detto Schmidt, aggiungendo che ci sono anche potenziali applicazioni per le procedure mediche, come i trapianti di organi.
“Durante i trapianti, l'organo attraversa un periodo in cui non ha alcun flusso di ossigeno o di sangue, ma una volta che è trapiantato, ottiene un flusso di sangue ossigenato che provoca uno scoppio di stress ossidativo”, ha detto Schmidt. “Ora che stiamo cominciando a capire questi meccanismi, forse possiamo fare qualcosa di più sofisticato per permettere alle cellule di un organo trapiantato di prepararsi e proteggersi”.
Il team di ricerca di Schmidt ha lavorato con altri quattro gruppi provenienti da tutto il mondo che hanno portato conoscenze su chimica biologica dello zolfo, biologia redox, biologia cellulare e segnalazione cellulare. I prossimi passi in questa ricerca, ha detto Schmidt, comprendono le indagini su come le cellule riescono precisamente ad aggiungere quelle molecole extra di zolfo e come è regolato questo processo.
“È possibile che capendo meglio questo sistema, possiamo fare progressi”, ha detto Schmidt. “Capire alcuni di questi meccanismi ci permette di elaborare nuove idee”.
Fonte: Reagan Colyer in Montana State University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: É. Dóka, T. Ida, M. Dagnell, Y. Abiko, N. C. Luong, N. Balog, T. Takata, B. Espinosa, A. Nishimura, Q. Cheng, Y. Funato, H. Miki, J. M. Fukuto, J. R. Prigge, E. E. Schmidt, E. S. J. Arnér, Y. Kumagai, T. Akaike, P. Nagy. Control of protein function through oxidation and reduction of persulfidated states. Science Advances, 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV