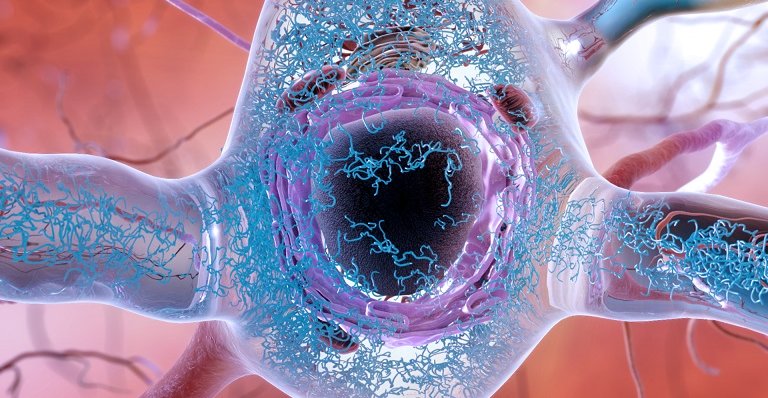
 Accumuli anomali della proteina Tau possono accumularsi all'interno dei neuroni, formando fili aggrovigliati e infine danneggiando la connessione sinaptica tra i neuroni. (Fonte: National Institute on Aging)
Accumuli anomali della proteina Tau possono accumularsi all'interno dei neuroni, formando fili aggrovigliati e infine danneggiando la connessione sinaptica tra i neuroni. (Fonte: National Institute on Aging)
Degli scienziati hanno scoperto un "Big Bang" del morbo di Alzheimer (MA) - il punto preciso in cui una proteina sana diventa tossica, ma non ha ancora formato i grovigli mortali nel cervello.
Uno studio condotto alla University of Texas Southwestern fornisce nuove informazioni sulla natura mutevole della forma di una molecola di tau, appena prima che inizi ad attaccarsi ad altre simili per formare aggregati più grandi. La rivelazione offre una nuova strategia per individuare la malattia devastante prima che si imponga e ha generato uno sforzo per sviluppare trattamenti che stabilizzano le proteine tau prima che cambino forma.
"Questa è forse la più grande scoperta che abbiamo fatto fino ad oggi, anche se ci vorrà probabilmente un po' di tempo prima che si concretizzino dei benefici in clinica. Questo cambia molto il nostro modo di pensare al problema", ha detto il Dott. Marc Diamond, direttore del Centro Alzheimer e Malattie Neurodegenerative della UT Southwestern ed esperto di demenza al quale è riconosciuta la scoperta che la tau si comporta come un prione, una proteina infettiva che si auto-replica.
Lo studio pubblicato su eLife contraddice la precedente convinzione che una proteina tau isolata non ha una forma distinta e diventa dannosa solo dopo che inizia a unirsi con altre proteine tau per formare i nodi visibili nel cervello dei pazienti di MA.
Gli scienziati hanno fatto la scoperta dopo aver estratto proteine tau dal cervello umano e averle isolate come singole molecole. Hanno scoperto che la forma dannosa di tau espone una parte di sé, che di norma è piegata all'interno. Questa parte esposta la induce ad aderire ad altre proteine tau, consentendo la formazione dei grovigli che uccidono i neuroni.
"Pensiamo che questo sia il 'Big Bang' della patologia tau", ha detto il dottor Diamond, riferendosi alla teoria scientifica prevalente sulla formazione dell'universo. "Questo è un modo di scrutare proprio l'inizio del processo patologico. Ci riporta indietro a un punto molto discreto in cui vediamo l'apparizione del primo cambiamento molecolare che porta alla neurodegenerazione nel MA. Questo lavoro si basava su una stretta collaborazione con il mio collega, il dottor Lukasz Joachimiak".
Nonostante miliardi di dollari spesi per le sperimentazioni cliniche nel corso dei decenni, il MA rimane una delle malattie più devastanti e sconcertanti del mondo, colpendo oltre 35 milioni di persone. Il dottor Diamond è fiducioso che il campo scientifico abbia girato l'angolo, osservando che avendo identificato la genesi della malattia, gli scienziati hanno un obiettivo vitale per diagnosticare la condizione nella sua fase iniziale, prima che diventino evidenti i sintomi della perdita di memoria e del declino cognitivo.
I prossimi passi del suo team sono lo sviluppo di un semplice test clinico che analizzi il sangue o il fluido spinale di un paziente per rilevare i primi segni biologici della proteina tau anormale. Ma altrettanto importante, ha detto il dott. Diamond, sono gli sforzi in corso per sviluppare un trattamento che renderebbe attuabile la diagnosi.
E cita una ragione convincente per un cauto ottimismo: il Tafamidis, un farmaco approvato di recente, stabilizza una proteina diversa che cambia forma, chiamata transtiretina, che provoca un accumulo letale di proteine nel cuore, simile al modo in cui la tau travolge il cervello.
"La caccia è aperta per usare questa scoperta e produrre un trattamento che blocca la neurodegenerazione dove inizia", ha detto il dott. Diamond. "Se funziona, l'incidenza del MA potrebbe essere ridotta sostanzialmente. Sarebbe fantastico".
Il laboratorio del Dr. Diamond, in prima linea in molti importanti risultati relativi alla tau, aveva stabilito in precedenza che la tau si comporta come un prione - una proteina infettiva che può diffondersi come un virus attraverso il cervello. Il laboratorio ha stabilito che la proteina tau nel cervello umano può formare molti ceppi distinti, o strutture auto-replicanti, e ha sviluppato metodi per riprodurli in laboratorio. La sua ricerca più recente indica che una singola forma patologica di proteina tau può avere molteplici forme possibili, ciascuna associata a una forma diversa di demenza.
Fonte: UT Southwestern Medical Center (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Hilda Mirbaha, Dailu Chen, Olga A Morazova, Kiersten M Ruff, Apurwa M Sharma, Xiaohua Liu, Mohammad Goodarzi, Rohit V Pappu, David W Colby, Hamid Mirzaei, Lukasz A Joachimiak, Marc I Diamond. Inert and seed-competent tau monomers suggest structural origins of aggregation. eLife, 2018; 7 DOI: 10.7554/eLife.36584
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV