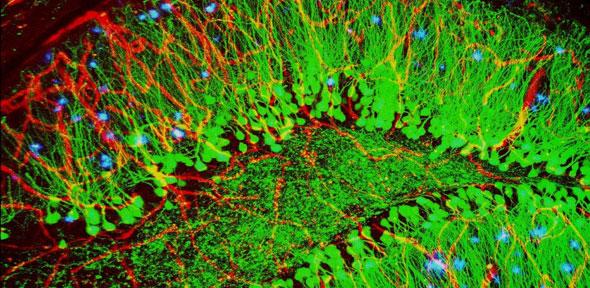
 In azzurro si notano le proteine caratteristiche dell'Alzheimer (placche) nel tessuto cerebrale. Fonte: ZEISS MicroscopyDei ricercatori hanno sviluppato una nuova tecnica di scansione che rende possibile studiare il motivo per cui le proteine associate all'Alzheimer e al Parkinson possono passare da innocue a tossiche. La tecnica usa una tecnologia chiamata «scansione multidimensionale a super-risoluzione» che permette di osservare variazioni delle superfici delle singole molecole proteiche quando si incollano l'una con l'altra.
In azzurro si notano le proteine caratteristiche dell'Alzheimer (placche) nel tessuto cerebrale. Fonte: ZEISS MicroscopyDei ricercatori hanno sviluppato una nuova tecnica di scansione che rende possibile studiare il motivo per cui le proteine associate all'Alzheimer e al Parkinson possono passare da innocue a tossiche. La tecnica usa una tecnologia chiamata «scansione multidimensionale a super-risoluzione» che permette di osservare variazioni delle superfici delle singole molecole proteiche quando si incollano l'una con l'altra.
Lo strumento può consentire ai ricercatori di individuare come si piegano male le proteine e infine diventano tossiche per le cellule nervose nel cervello, un possibile aiuto nello sviluppo di trattamenti per queste malattie devastanti.
I ricercatori dell'Università di Cambridge hanno studiato come cambia un fenomeno chiamato idrofobicità (mancanza di affinità per l'acqua) nelle proteine amiloide-beta e alfa-sinucleina (associate rispettivamente all'Alzheimer e al Parkinson) quando si raggruppano. Il legame tra l'idrofobicità e la tossicità di queste proteine era stato ipotizzato, ma questa è la prima volta è stato possibile vedere l'idrofobicità a una risoluzione così alta.
I dettagli dello studio sono (saranno) pubblicati nella rivista Nature Communications. "All'inizio queste proteine sono in una forma relativamente innocua, ma quando si aggregano insieme cambia qualcosa di importante", ha scritto il dottor Steven Lee dal Dipartimento di Chimica della Cambridge, autore senior dello studio. "Ma con le tecniche convenzionali di scansione non era possibile vedere cosa succede a livello molecolare".
Nelle malattie neurodegenerative come l'Alzheimer e il Parkinson, le proteine presenti naturalmente si ripiegano in una forma sbagliata e si raggruppano in strutture simili a filamenti chiamate «fibrille amiloidi» e in gruppi più piccoli e altamente tossici chiamati «oligomeri», ritenuti dannosi e mortali per i neuroni, ma il meccanismo esatto resta sconosciuto.
Negli ultimi due decenni, i ricercatori hanno cercato di sviluppare trattamenti che fermano la proliferazione di questi grumi nel cervello, ma per realizzare un tale trattamento dobbiamo capire con precisione come si formano gli oligomeri e perché. "C'è qualcosa di speciale negli oligomeri, e vogliamo sapere di che cosa si tratta", ha detto Lee. "Abbiamo sviluppato nuovi strumenti che ci aiuteranno a rispondere a queste domande".
Quando si usano tecniche di microscopia convenzionali, la fisica rende impossibile ingrandire oltre un certo punto. In sostanza, c'è una sfocatura innata alla luce, quindi quando si guarda attraverso un microscopio ottico sotto una certa dimensione tutto appare come un globo sfocato, semplicemente perché le onde luminose si propagano quando sono concentrate su un posto così piccolo. Le fibrille amiloidi e gli oligomeri sono più piccoli di questo limite, quindi è molto difficile vedere direttamente cosa sta succedendo.
Però le nuove tecniche a super-risoluzione, che sono da 10 a 20 volte migliori dei microscopi ottici, hanno permesso ai ricercatori di superare queste limitazioni e visualizzare i processi biologici e chimici su scala nanometrica. Lee e i suoi colleghi hanno portato un altro passo più avanti queste tecniche, e sono ora in grado di determinare non solo la posizione di una molecola, ma anche le proprietà ambientali di singole molecole simultaneamente.
Con la loro tecnica, chiamata sPAINT (spectrally-resolved Points Accumulation for Imaging in Nanoscale Topography - accumulo di punti spettralmente risolti per l'imaging in topografia a nanoscala), i ricercatori hanno usato una molecola di colorante per mappare l'idrofobicità di fibrille amiloidi e oligomeri implicati nelle malattie neurodegenerative.
La tecnica sPAINT è facile da implementare, richiede solo l'aggiunta di un singolo gradiente di diffrazione della trasmissione su un microscopio a super-risoluzione. Secondo i ricercatori, la possibilità di mappare l'idrofobicità su nanoscala potrebbe essere usato per capire anche altri processi biologici in futuro.
La ricerca è stata finanziata dal Medical Research Council, dall'Engineering and Physical Sciences Research Council, dalla Royal Society e dall'Augustus Newman Foundation.
Fonte: University of Cambridge (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Marie N. Bongiovanni et al. ‘Multi-dimensional super-resolution imaging enables surface hydrophobicity mapping’. Nature Communications (2016). DOI: 10.1038/NCOMMS13544
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV