Uno studio condotto da ricercatori del MGH ha individuato quello che sembra essere un interruttore molecolare che controlla i processi infiammatori coinvolti in condizioni che vanno dall'atrofia muscolare all'Alzheimer.
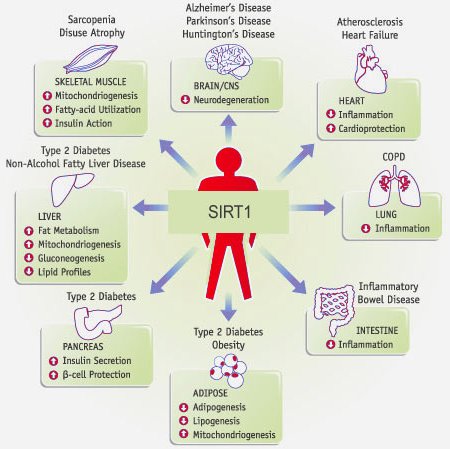 Tutte le malattie umane coinvolte nell'azione dell'enzima SIRT1 (Fonte: Sci-news.com)Uno studio condotto da ricercatori del Massachusetts General Hospital (MGH) ha individuato quello che sembra essere un interruttore molecolare che controlla i processi infiammatori coinvolti in condizioni che vanno dall'atrofia muscolare all'Alzheimer.
Tutte le malattie umane coinvolte nell'azione dell'enzima SIRT1 (Fonte: Sci-news.com)Uno studio condotto da ricercatori del Massachusetts General Hospital (MGH) ha individuato quello che sembra essere un interruttore molecolare che controlla i processi infiammatori coinvolti in condizioni che vanno dall'atrofia muscolare all'Alzheimer.
Nel loro rapporto pubblicato su Science Signaling, il team di ricerca ha scoperto che è necessaria l'azione della molecola di segnalazione ossido nitrico sulla proteina normativa SIRT1 per indurre l'infiammazione e la morte cellulare nei modelli cellulari e animali di diverse malattie legate all'invecchiamento.
"Dal momento che sono stati identificati meccanismi patologici diversi per malattie come il diabete di tipo 2, l'aterosclerosi e il Parkinson, si è ipotizzato che anche le strategie terapeutiche per queste condizioni dovrebbero essere diverse", dice Masao Kaneki, MD, PhD, del Department of Anesthesia, Critical Care and Pain Medicine al MGH, l'autore senior della ricerca. "Al contrario, i nostri risultati hanno identificato l'inattivazione, mediata dall'ossido nitrico, della SIRT1 (ritenuto un gene della longevità) come centro della spirale infiammatoria comune a molte malattie legate all'invecchiamento, chiarendo un nuovo target molecolare preventivo".
Altri studi hanno chiarito il ruolo dell'ossido di azoto nel diabete, nelle neurodegenerazioni, nell'aterosclerosi e in altre malattie legate all'invecchiamento, note per coinvolgere infiammazione cronica. Ma non si conosceva il modo esatto in cui l'ossido nitrico esercita tali effetti, compresa l'attivazione del fattore infiammatorio NF-kB e della proteina normativa p53, che può indurre la morte delle cellule danneggiate.
Sappiamo che il SIRT1 sopprime l'attività sia del NF-kB che della p53, e poichè la sua disregolazione è stata associata a modelli di diverse condizioni legate all'invecchiamento, il team di ricerca si è concentrato sulla soppressione della SIRT1 da parte dell'ossido di azoto, attraverso un processo chiamato S-nitrosilazione.
Gli esperimenti cellulari hanno rivelato che la S-nitrosilazione disattiva la SIRT1 interferendo con la capacità della proteina di legare lo zinco, che a sua volta aumenta l'attivazione della p53 e di una subunità della proteina di NF-kB. Gli esperimenti su topi modello di infiammazione sistemica, di atrofia muscolare legata all'età e di Parkinson, hanno scoperto che il blocco o la rimozione del sintasi NO (l'enzima che induce la produzione di ossido nitrico) impediscono gli effetti cellulari (e comportamentali per il Parkinson) delle malattie. Ulteriori esperimenti hanno individuato la S-nitrosilazione della SIRT1 come un punto critico nella catena di eventi che porta dall'espressione dell'ossido nitrico al danno cellulare e alla morte.
"Indipendentemente dall'evento originale che scatena questo processo, una volta avviata dalla disattivazione della SIRT1, la stessa cascata di infiammazione potenziata e di morte cellulare porta a molti disturbi diversi", dice Kaneki, professore associato di anestesia alla Harvard Medical School. "Anche se dobbiamo confermare che quello che abbiamo scoperto nei modelli di roditori è all'opera anche nelle malattie umane, credo che questo processo abbia un ruolo importante nella patogenesi di condizioni come il diabete legato all'obesità, l'aterosclerosi, l'Alzheimer e la risposta del corpo al trauma grave. Stiamo ora cercando di identificare delle piccole molecole in grado di inibire specificamente la S-nitrosilazione della SIRT1 e delle relative proteine e sopprimere questo interruttore pro-infiammatorio".
****
Hanno collaborato alla ricerca Shohei Shinozaki, PhD, Tokyo Medical and Dental University e Kyungho Chang, MD, PhD, dell'Università di Tokyo, entrambi ex borsisti di ricerca alla MGH; Michihiro Sakai, Nobuyuki Shimizu, Marina Yamada, Tomokazu Tanaka, MD, PhD, Harumasa Nakazawa, MD e Fumito Ichinose, MD, PhD, tutti del MGH; e Jonathan S. Stamler, MD, Case Western Reserve University e University Hospital di Cleveland. Lo studio è stato finanziato dai National Institutes of Health, dalla Defense Advanced Research Project Agency; dalla American Diabetes Association, e dai Shriners Hospitals for Children.
Fonte: Massachusetts General Hospital (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: S. Shinozaki, K. Chang, M. Sakai, N. Shimizu, M. Yamada, T. Tanaka, H. Nakazawa, F. Ichinose, Y. Yamada, A. Ishigami, H. Ito, Y. Ouchi, M. E. Starr, H. Saito, K. Shimokado, J. S. Stamler, M. Kaneki. Inflammatory stimuli induce inhibitory S-nitrosylation of the deacetylase SIRT1 to increase acetylation and activation of p53 and p65. Science Signaling, 2014; 7 (351): ra106 DOI: 10.1126/scisignal.2005375
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |














 Associazione Alzheimer OdV
Associazione Alzheimer OdV