Dei ricercatori mostrano come si formano gli aggregati tossici all'interno delle cellule cerebrali e come bloccare il processo di uccisione cellulare, che può anche essere al lavoro nell'Alzheimer e in altre.malattie neurodegenerative.
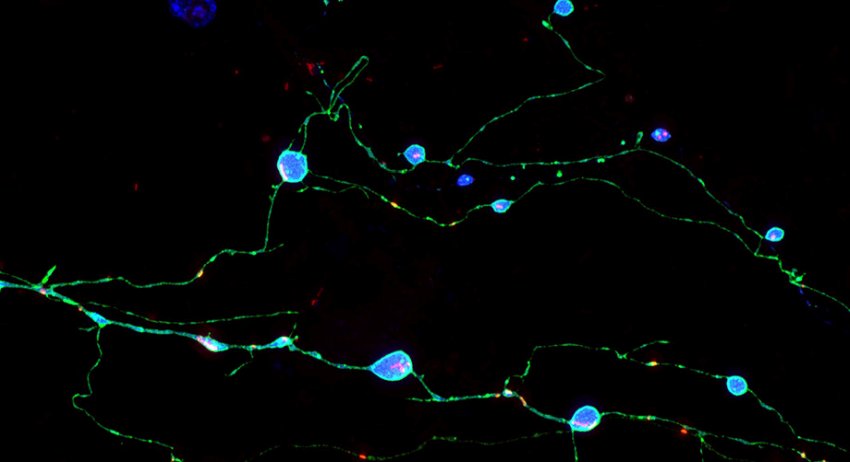 Neuroni coltivati che esprimono proteine prioni mutanti (ciano) causa di malattia da prioni negli esseri umani. Questi neuroni mostrano assoni rigonfi che contengono aggregati di proteine mutanti tossiche. (Fonte: Adriaan Verhelle e Yin Wu / Scripps Research)
Neuroni coltivati che esprimono proteine prioni mutanti (ciano) causa di malattia da prioni negli esseri umani. Questi neuroni mostrano assoni rigonfi che contengono aggregati di proteine mutanti tossiche. (Fonte: Adriaan Verhelle e Yin Wu / Scripps Research)
Le malattie da prioni, come la malattia di Creutzfeldt-Jakob (CJD), sono sindromi fastidiose e fatali di demenza associate alla formazione di aggregati di proteine prioni (PrP). Come si formano questi aggregati dentro le cellule cerebrali, e le uccidono, non è mai stato chiarito del tutto, ma un nuovo studio eseguito allo Scripps Research suggerisce che gli aggregati uccidono i neuroni danneggiando i loro assoni, le strette fibre nervose attraverso le quali inviano segnali ad altri neuroni.
L'accumulo di aggregati di proteine negli assoni, insieme ai gonfiori assonali e ad altri segni di disfunzione, sono caratteristiche iniziali anche di altri disturbi neurodegenerativi che includono l'Alzheimer e il Parkinson. La scoperta del modo in cui si formano questi aggregati di prioni negli assoni e come impedirlo, riferito su Science Advances, può infine avere un significato che va ben oltre le malattie da prioni.
L'autrice senior dello studio Sandra Encalada PhD, prof.ssa associata nel Dipartimento di Medicina molecolare allo Scripps Research, afferma:
"Siamo fiduciosi che questi risultati porteranno a una migliore comprensione dei prioni e di altre malattie neurodegenerative, nonché a nuove strategie per trattarle".
Nel loro studio i ricercatori hanno osservato attentamente le copie mutanti, causa di malattia, di PrP che formano grandi aggregati negli assoni dei neuroni, ma non nei loro corpi cellulari. La formazione di questi aggregati è seguita da segni di disfunzione assonale e alla fine dalla morte neuronale.
Gli scienziati hanno trovato prove che i processi di smaltimento dei rifiuti dei neuroni sono di norma in grado di far fronte a tali aggregati, quando sono all'interno o vicino ai corpi cellulari dei neuroni, ma lo sono molto meno quando gli aggregati si accumulano lontano, negli assoni.
I ricercatori hanno anche identificato un complesso di proteine chiave come responsabili di dirigere le PrP negli assoni, e di causare l'aggregazione associata a grandi gonfiori assonali. Hanno dimostrato che silenziare ognuna di queste proteine potrebbe impedire la formazione degli aggregati e proteggere i neuroni da danni e morte.
Assoni vulnerabili
La CJD è la malattia da prioni umana più comune, che insorge al ritmo di circa un caso per milione di persone all'anno in tutto il mondo. La maggior parte dei casi si ritiene che sorga spontaneamente quando le PrP sono alterate in qualche modo nel cervello e iniziano ad aggregarsi.
Poiché questi aggregati crescono con un processo di reazione a catena che attinge dalle copie sane di PrP, in rari casi (per esempio, durante l'operazione chirurgica di trapianto corneale) possono trasmettere la CJD da una persona all'altra. Circa il 15% dei casi è ereditario, causato da mutazioni che rendono le PrP più prone ad aggregarsi. I disturbi da prioni si verificano in altri mammiferi e si considera che siano causati da aggregazioni tossiche simili di specie diverse di proteine PrP.
Nello studio, la squadra della Encalada ha usato cellule cerebrali di topo contenenti PrP mutanti, insieme a tecniche di microscopia con immagini in movimento, per studiare l'accumulo iniziale di aggregati di PrP negli assoni. L'assone di un neurone è spesso molto lungo in relazione al suo corpo principale - il soma - e si è rivelato univocamente vulnerabile alle rotture dei suoi sistemi delicati di trasporto di molecole essenziali e di quelli per l'eliminazione dei rifiuti.
La funzione ordinaria delle PrP nei neuroni non è mai stata chiarita, ma la proteina sembra essere secreta normalmente, tramite contenitori simili a sacchetti chiamati vescicole, dal soma e dall'assone, dove a volte ritorna per essere riciclata o degradata come rifiuto. I ricercatori hanno scoperto nei loro esperimenti che anche le PrP mutanti prodotte nel soma sono in gran parte incapsulate in vescicole che si trasferiscono nell'assone lungo binari chiamati microtubuli.
Questo movimento coinvolge un sistema di traffico di vescicole in qualche modo complesso, e i ricercatori hanno osservato che questo sistema devia gran parte delle PrP molto lontano, negli assoni, dove le vescicole contenenti PrP si uniscono e si fondono.
Le PrP mutanti in questa situazione formano grandi aggregati (la Encalada li chiama endoggresomi) di cui gli assoni non possono sbarazzarsi. Gli aggregati portano a gonfiori assonali e altri segni di disfunzione, compresa una riduzione della segnalazione neuronale del calcio e, in definitiva a un tasso di mortalità neuronale molto più alto rispetto ai neuroni con PrP normali.
I ricercatori hanno anche trovato un modo per contrastare la formazione di endoggresomi. Hanno identificato quattro proteine (Arl8, kinesina-1, Vps41 e SKIP) che sono responsabili della deviazione delle vescicole contenenti PrP verso gli assoni, di portarle lontano nel soma e di fonderle con altre vescicole contenenti PrP attivando la formazione di aggregati.
Quando hanno silenziato una di queste proteine, negli assoni sono entrate molte meno vescicole contenenti PrP, gli assoni hanno mostrato pochi segni, o nessuno, di aggregazione, e i neuroni hanno funzionato normalmente o quasi normalmente e sono sopravvissuti come le cellule cerebrali normali.
I risultati puntano alla possibilità allettante che le malattie da prioni, e forse molte altre malattie con aggregati di proteine del cervello, possono essere prevenute o trattate interrompendo, almeno temporaneamente, il traffico che porta negli assoni le proteine aggregate incapsulate-in-vescicola, e prone all'aggregazione.
"Siamo molto entusiasti della scoperta di molecole che possono inibire questo percorso che forma aggregati e di studiare gli effetti di tali inibitori nei modelli animali di prioni e di altre malattie neurodegenerative", afferma la Encalada.
Fonte: Scripps Research Institute (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Romain Chassefeyre, Tai Chaiamarit, Adriaan Verhelle, Sammy Weiser Novak, Leonardo Andrade, André Leitão, 5Uri Manor, Sandra Encalada. Endosomal sorting drives the formation of axonal prion protein endoggresomes. Science Advances, 22 Dec 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV