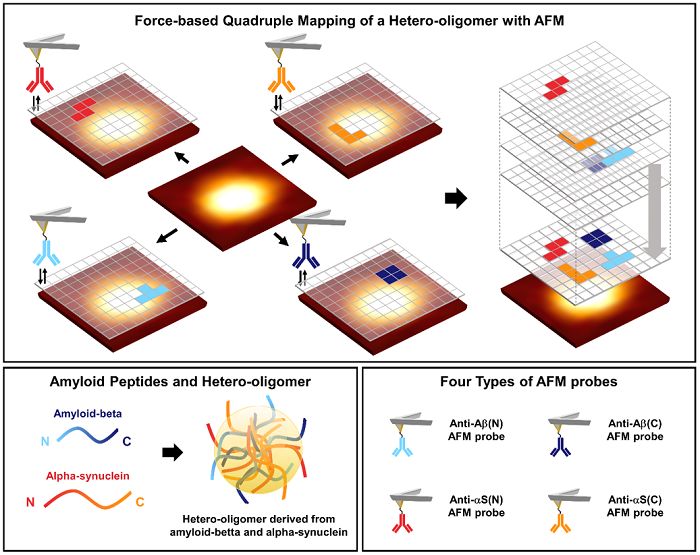
 Schema di mappatura della forza quadrupla degli etero-oligomeri derivati da amiloide-beta e alfa-sinucleina.
Schema di mappatura della forza quadrupla degli etero-oligomeri derivati da amiloide-beta e alfa-sinucleina.
Il morbo di Alzheimer (MA), la causa più diffusa di demenza, che riduce gradualmente le funzioni della memoria e cognitive a causa della deformazione e morte dei neuroni, e il morbo di Parkinson (MP) che provoca tremori alle mani e alle braccia che ostacolano il normale movimento, sono malattie neurodegenerative importanti. Recentemente, un team di ricerca del POSTECH ha identificato la struttura dell'agente che provoca la compresenza di MA e MP.
Un team di ricerca guidato dal prof. Jooon Won Park e dal dottorando Eun Ji Shin del POSTECH ha studiato la struttura superficiale degli etero-oligomeri presenti nella sovrapposizione di MA e MP, usando la microscopia a forza atomica (AFM) per rivelare la loro identità strutturale. Questo studio è pubblicato su Nano Letters.
Sappiamo che la sovrapposizione patologica di MA e MP è associata alla formazione di etero-oligomeri derivati da amiloide-beta e alfa-sinucleina. Tuttavia, finora è stato difficile studiare un trattamento a causa dei limiti tecnici per osservare la loro struttura. Per questo, i ricercatori hanno usato l'AFM per osservare la caratteristica della superficie dei nano-aggregati di etero-oligomero derivati da amiloide-beta, noto biomarcatore del MA, e da alfa-sinucleina, noto biomarcatore del MP, a livello di molecola singola.
Quando il team di ricerca ha studiato con AFM 4 indizi immobilizzati con anticorpi che riconoscono N-Terminus o C-terminus di ciascun peptide, ha assodato che tutti gli aggregati erano etero-oligomeri. Inoltre, nel caso di etero-oligomero, hanno chiarito che la probabilità di riconoscere la fine del peptide è superiore a quella dell'omo-oligomero (aggregato proteico derivato da un singolo peptide di amiloide-beta o alfa-sinucleina).
Questo risultato indica che la fine di ciascun peptide ha una tendenza più grande a essere posizionata sulla superficie degli etero-oligomeri rispetto agli omo-oligomeri, o che le estremità dei peptidi situati sulla superficie hanno più gradi di libertà. Cioè, può essere confermato che l'aggregazione tra i peptidi è impacchettata meno strettamente nell'etero-oligomero che nell'omo-oligomero.
Questo è il primo studio a osservare la struttura dei nano-aggregati di proteine disordinate, che non è mai stato identificato prima, usando la mappatura quadrupla con quattro indizi AFM. È la base sperimentale per verificare l'ipotesi dell'aggregazione etero-oligomerica. Può anche essere usato negli studi relativi ai fenomeni sovrapposti di varie malattie neurodegenerative diverse da MA e MP.
"Fino ad ora, non c'era un metodo adeguato per analizzare i nano-aggregati, rendendo impossibile chiarire l'identità strutturale degli aggregati eterogenei", ha spiegato il professor Joon Won Park. "Poiché il metodo di analisi sviluppato in questo studio è applicabile ad altri aggregati di proteine amiloidi, esso contribuirà a identificare la causa dell'Alzheimer o della malattia della mucca pazza".
Fonte: Pohang University of Science & Technology (POSTECH) (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Eun Ji Shin, Joon Won Park. Nanoaggregates Derived from Amyloid-beta and Alpha-synuclein Characterized by Sequential Quadruple Force Mapping. Nano Letters, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV