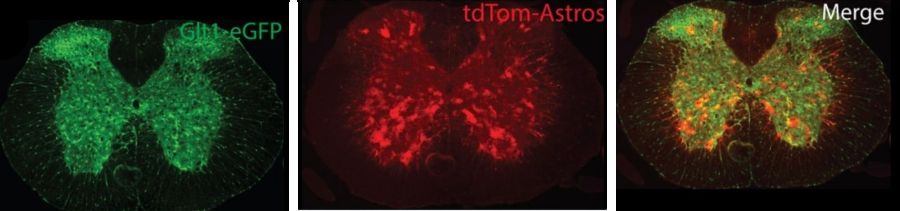
 Astrociti rossi 8,3 nel cervello di topo (Fonte: Rothstein lab)
Astrociti rossi 8,3 nel cervello di topo (Fonte: Rothstein lab)
Ricercatori della Johns Hopkins University annunciano di aver trovato nuove evidenze, su tessuti umani e di topo, che una proteina pompata fuori da alcune - ma non tutte - popolazioni di cellule 'aiutanti' nel cervello, chiamate astrociti, ha un ruolo specifico nel dirigere la formazione di connessioni tra neuroni necessari per l'apprendimento e la formazione di nuovi ricordi.
Usando topi geneticamente modificati e generati con meno connessioni di questo tipo, i ricercatori hanno condotto esperimenti di concetto che dimostrano la possibilità di fornire proteine correttive tramite nanoparticelle, per sostituire le proteine mancanti necessarie per le 'riparazioni stradali' sull'autostrada neurale difettosa.
Poiché tali reti connettive vengono perse o danneggiate nelle malattie neurodegenerative (come l'Alzheimer) o in alcuni tipi di disabilità intellettiva (come la malattia di Norrie), i ricercatori affermano che i loro risultati fanno avanzare gli sforzi per riformare e riparare le reti e, potenzialmente, ripristinare la normale funzione cerebrale.
Jeffrey Rothstein MD/PhD, direttore del Brain Science Institute e professore di neurologia alla Johns Hopkins University, autore senior dello studio pubblicato nel numero di maggio di Nature Neuroscience, afferma:
"Stiamo esaminando la biologia fondamentale del funzionamento degli astrociti, ma forse abbiamo scoperto un nuovo obiettivo per intervenire un giorno nelle malattie neurodegenerative con nuove terapie. Sebbene gli astrociti sembrino tutti uguali nel cervello, abbiamo avuto un indizio che potrebbero avere ruoli specializzati nel cervello a causa delle differenze regionali nella funzione del cervello e dei cambiamenti osservati in alcune malattie.
"La speranza è che, imparando a sfruttare le differenze individuali in queste popolazioni distinte di astrociti, possiamo dirigere lo sviluppo del cervello o addirittura invertire gli effetti di determinate condizioni cerebrali, e i nostri studi attuali hanno avanzato quella speranza".
Gli astrociti sono cellule di supporto nel cervello che fungono da guida per dirigere nuove cellule, promuovere la segnalazione chimica e ripulire i sottoprodotti del metabolismo delle cellule cerebrali. Il team di Rothstein si è concentrato su una particolare proteina di astrociti, il trasportatore di glutammato-1 che, secondo studi precedenti, era perso dagli astrociti in alcune parti del cervello nelle malattie neurodegenerative.
Come un aspirapolvere biologico, la proteina di norma aspira il prodotto chimico 'messaggero' glutammato dagli spazi tra i neuroni dopo che un messaggio viene inviato a un'altra cellula, un passaggio necessario per terminare la trasmissione e impedire l'accumulo di livelli tossici di glutammato.
Quando questi trasportatori di glutammato scompaiono da alcune parti del cervello - come la corteccia motoria e il midollo spinale nelle persone con sclerosi laterale amiotrofica (SLA) - il glutammato vi rimane troppo a lungo, inviando messaggi che sovraeccitano e uccidono le cellule.
Per capire come il cervello decide quali cellule necessitano dei trasportatori di glutammato, Rothstein e colleghi si sono concentrati sulla regione del DNA di fronte al gene che di solito controlla l'interruttore on-off necessario per produrre la proteina. Hanno progettato geneticamente dei topi in modo che brillassero di rosso in ogni cellula in cui il gene è attivo.
Normalmente, il trasportatore di glutammato è attivo in tutti gli astrociti. Ma usando segmenti di codice DNA compresi tra 1.000 e 7.000 bit dall'interruttore on-off del glutammato, tutte le cellule del cervello si illuminarono di rosso, compresi i neuroni. Solo quando i ricercatori hanno provato la sequenza più grande di un codice DNA a 8.300 bit da questa posizione, hanno iniziato a vedere una selezione nelle cellule rosse. Queste cellule rosse erano tutti astrociti ma solo in alcuni strati della corteccia cerebrale nei topi.
Poiché sono riusciti a identificare questi 'astrociti rossi 8,3', i ricercatori hanno pensato che avrebbero potuto avere una funzione specifica diversa da altri astrociti nel cervello. Per scoprire più precisamente cosa fanno questi astrociti rossi 8,3 nel cervello, i ricercatori hanno usato una macchina di selezione delle cellule per separare gli astrociti rossi da quelli non colorati nel tessuto corticale del cervello di topo, e quindi hanno identificato quali geni si sono attivati molto più in alto rispetto a livelli usuali in rosso in confronto alle popolazioni cellulari non colorate. I ricercatori hanno scoperto che gli astrociti rossi 8,3 attivano livelli elevati di un gene che codifica una diversa proteina, chiamata Norrin.
Il team di Rothstein ha preso i neuroni dal cervello di topi normali, li ha trattati con Norrin e ha scoperto che quei neuroni generavano più 'rami' - o estensioni - usati per trasmettere messaggi chimici tra le cellule cerebrali. Quindi, dice Rothstein, i ricercatori hanno esaminato il cervello dei topi progettati per non avere Norrin e hanno visto che questi neuroni avevano meno rami rispetto ai topi sani che producevano Norrin.
In un'altra serie di esperimenti, il team di ricerca ha preso il codice DNA del Norrin più la 'posizione' 8.300 del DNA e li ha assemblati in nanoparticelle trasportabili. Quando hanno iniettato le nanoparticelle di Norrin nel cervello dei topi progettati senza Norrin, i neuroni in questi topi hanno iniziato a far crescere rapidamente molti più rami, un processo che suggerisce la riparazione delle reti neurali. Hanno ripetuto questi esperimenti anche con i neuroni umani.
Rothstein osserva che le mutazioni nella proteina Norrin, che riducono i livelli di proteina nelle persone, causano la malattia di Norrie, un disturbo genetico raro che può portare alla cecità nell'infanzia e alla disabilità intellettiva. Poiché i ricercatori sono riusciti a far crescere nuovi rami di comunicazione, ritengono che un giorno potrebbe essere possibile usare la Norrin per trattare alcuni tipi di disabilità intellettive come la malattia di Norrie.
Come prossimi passi, i ricercatori stanno studiando se la Norrin è in grado di riparare le connessioni nel cervello di modelli animali con malattie neurodegenerative e, in vista di un possibile successo, Miller e Rothstein hanno presentato domanda di brevetto per la Norrin.
Fonte: Johns Hopkins University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Sean J. Miller, Thomas Philips, Namho Kim, Raha Dastgheyb, Zhuoxun Chen, Yi-Chun Hsieh, J. Gavin Daigle, Malika Datta, Jeannie Chew, Svetlana Vidensky, Jacqueline T. Pham, Ethan G. Hughes, Michael B. Robinson, Rita Sattler, Raju Tomer, Jung Soo Suk, Dwight E. Bergles, Norman Haughey, Mikhail Pletnikov, Justin Hanes, Jeffrey D. Rothstein. Molecularly defined cortical astroglia subpopulation modulates neurons via secretion of Norrin. Nature Neuroscience, 2019, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV