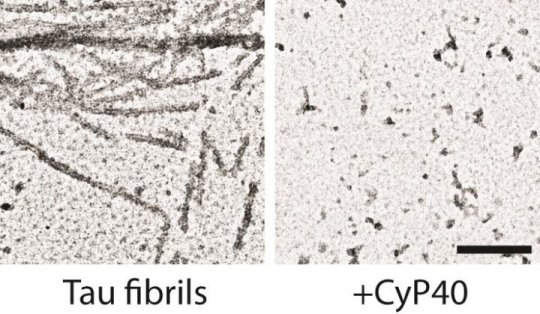
 Le fibrille di Tau (a sinistra) sono disaggregate dopo 3 ore di incubazione con CyP40 (a destra) nell'ingrandimento 60.000x, barra di scala 200nm del microscopio elettronico. (Fonte: Jeremy D. Baker)
Le fibrille di Tau (a sinistra) sono disaggregate dopo 3 ore di incubazione con CyP40 (a destra) nell'ingrandimento 60.000x, barra di scala 200nm del microscopio elettronico. (Fonte: Jeremy D. Baker)
Un enzima umano, chiamato ciclofilina 40 o CyP40, può sciogliere gli aggregati di proteine che contribuiscono sia all'Alzheimer che al Parkinson, secondo uno studio guidato da ricercatori della University of South Florida di Tampa e appena pubblicato sulla rivista PLOS Biology. La scoperta potrebbe indicare una nuova strategia terapeutica per queste malattie.
Questa è la prima volta che il CyP40 ha dimostrato di disaggregare o sciogliere una forma tossica e solubile di amiloide responsabile di una malattia neurodegenerativa, secondo Laura Blair PhD, assistente professore del Dipartimento di Medicina Molecolare all'USF Health Byrd Alzheimer’s Institute. La Blair e i suoi colleghi dell'USF hanno lavorato con ricercatori di diverse istituzioni in Germania.
Lo studio ha scoperto che il CyP40 potrebbe ridurre la quantità di tau aggregata, convertendola in una forma più solubile e meno tossica. In topi modello di una malattia simile all'Alzheimer, l'espressione sperimentale di CyP40 ha preservato i neuroni del cervello e invertito il deficit cognitivo. Lo stesso enzima disaggrega anche l'alfa-sinucleina, un aggregato associato al Parkinson.
Nella maggior parte delle malattie neurodegenerative, le proteine misfolded [mal ripiegate] si accumulano anormalmente per formare un grumo insolubile chiamato amiloide. Molte proteine che formano l'amiloide, compresa la tau nell'Alzheimer e l'α-sinucleina nel Parkinson, contengono l'aminoacido prolina, che con la sua struttura univoca induce una curva nella catena di aminoacidi. Quelle curve contribuiscono a far accatastare regioni adiacenti alla proteina, promuovendo la formazione di grumi. Il CyP40 può sciogliere questi blocchi insolubili interagendo con le proline all'interno della struttura amiloide.
L'esatto meccanismo con cui il CyP40 riduce l'aggregazione non è ancora chiaro, e gli autori forniscono due possibilità. L'enzima può legarsi alla proteina aggregata e, invertendo la curva della prolina, aiuta a staccare e separare la catena degli aminoacidi. Il supporto a questo modello deriva dall'osservazione che l'enzima era meno efficace nel ridurre gli aggregati quando la sua azione veniva inibita. In alternativa, l'enzima può legarsi alla proteina prima che formi gli aggregati, la segrega e quindi previene la formazione potenzialmente dannosa di grumi.
Comprendere più in dettaglio come funziona l'enzima può aiutare a puntare verso una strategia terapeutica incentrata sul ruolo della prolina nella formazione dell'amiloide.
"La scoperta che il Cyp40 riesce a sciogliere i grumi di tau e di alfa-sinucleina suggerisce che esso, o una delle altre più di 40 proteine umane con attività simile, può avere un ruolo nel trattamento delle malattie neurodegenerative", ha dichiarato la Blair.
Lo studio è stato finanziato dai National Institutes of Health, dall'Alzheimer's Association e dalla Veterans Health Administration.
Fonte: University of South Florida in Tampa (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Jeremy D. Baker, Lindsey B. Shelton, Dali Zheng, Filippo Favretto, Bryce A. Nordhues, April Darling, Leia E. Sullivan, Zheying Sun, Parth K. Solanki, Mackenzie D. Martin, Amirthaa Suntharalingam, Jonathan J. Sabbagh, Stefan Becker, Eckhard Mandelkow, Vladimir N. Uversky, Markus Zweckstetter, Chad A. Dickey, John Koren, Laura J. Blair. Human cyclophilin 40 unravels neurotoxic amyloids. PLOS Biology, 2017; 15 (6): e2001336 DOI: 10.1371/journal.pbio.2001336
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV