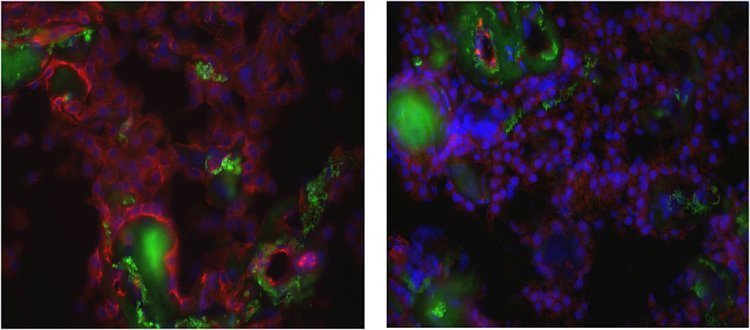
 Due colorazioni del plesso coroideo umano. A sinistra un plesso coroideo sano (da donatore con fase Braak 0,1). A destra un plesso coroideo danneggiato dall'Alzheimer (fase Braak 5). In entrambe le immagini i punti blu sono nuclei di cellule. Si notano le stringhe di cellule presenti in forma di cavolfiore, che indicano la struttura del plesso coroideo. In entrambe le immagini c'è anche una colorazione verde simile, che indica l'autofluoresenza dell'invecchiamento tissutale. Nella figura a sinistra (plesso coroideo sano) c'è una considerevole colorazione rossa della proteina Claudin 5, mentre la stessa è quasi assente nella foto a destra. Questi dati indicano che la proteina Claudina 5 è assente nella barriera del plesso coroideo danneggiato e, di conseguenza, detta barriera probabilmente ha delle perdite nell'Alzheimer.
Due colorazioni del plesso coroideo umano. A sinistra un plesso coroideo sano (da donatore con fase Braak 0,1). A destra un plesso coroideo danneggiato dall'Alzheimer (fase Braak 5). In entrambe le immagini i punti blu sono nuclei di cellule. Si notano le stringhe di cellule presenti in forma di cavolfiore, che indicano la struttura del plesso coroideo. In entrambe le immagini c'è anche una colorazione verde simile, che indica l'autofluoresenza dell'invecchiamento tissutale. Nella figura a sinistra (plesso coroideo sano) c'è una considerevole colorazione rossa della proteina Claudin 5, mentre la stessa è quasi assente nella foto a destra. Questi dati indicano che la proteina Claudina 5 è assente nella barriera del plesso coroideo danneggiato e, di conseguenza, detta barriera probabilmente ha delle perdite nell'Alzheimer.
Anche se già Greci e Romani antichi associavano la vecchiaia con la demenza, è solo nel 1901 che lo psichiatra tedesco Alois Alzheimer ha diagnosticato il primo caso del Morbo di Alzheimer in una donna di 50 anni. Oggi l'Alzheimer rappresenta il 60-80% dei casi di demenza in tutto il mondo.
Le anomalie caratteristiche dei pazienti con la malattia sono la perdita progressiva di memoria (a breve termine), apatia, depressione, comunicazione alterata, scarsa capacità di giudizio, cambiamenti comportamentali, disorientamento, confusione, progressivo peggioramento delle abilità fisiche e mentali. Per adesso l'eziologia della malattiaè in gran parte sconosciuta, e non c'è cura.
All'interno di un cervello sano, le cellule nervose secernono continuamente una proteina chiamata amiloide-beta (Aß) nel liquido cerebrospinale del cervello (CSF). La norma è che l'eccesso di Aß è riversato dal cervello e dal CSF nel sangue ed eliminato attraverso la barriera emato-encefalica. Nel cervello di Alzheimer, l'Aß è presente a livelli elevati e in forma aggregata. Queste cosiddette placche amiloidi sono uno dei tratti distintivi della malattia.
Esistono diversi tipi di barriera: quella studiata di più (nella ricerca di Alzheimer) è la barriera emato-encefalica (BBB), che ricopre i principali vasi sanguigni nel cervello. Una barriera meno nota è la barriera emato-liquido cerebrospinale (BCSFB), che riveste una piccola struttura a forma di cavolfiore (chiamata plesso coroideo) che sporge nei ventricoli cerebrali.
Recenti evidenze, risultanti soprattutto dalla ricerca su modelli animali, suggeriscono che il malfunzionamento del plesso coroideo ha un ruolo importante, se non essenziale, nella malattia neurodegenerativa e può avere gravi conseguenze per la normale funzione cerebrale.
Nello studio appena pubblicato su BMC Genomics, i ricercatori volevano capire se un malfunzionamento del plesso coroideo negli esseri umani ha un ruolo nell'Alzheimer. Inoltre, volevano scoprire la serie di eventi molecolari che hanno il potenziale di causare il malfunzionamento del plesso coroideo umano in questa malattia. In effetti, quest'ultima questione è particolarmente importante per la progettazione razionale di terapie molecolari o cellulari future.
Gli scienziati hanno isolato il plesso coroideo di donatori umani di cervello con Alzheimer (stadi Braak 5 o 6) e senza (fasi Braak 0 o 1). [ndt: Gli stadi/fasi Braak sono una classificazione del grado di patologia nell'Alzheimer e nel Parkinson].
Essi hanno confrontato questi campioni di plesso coroideo con il microscopio, con la colorazione delle proteine e a livello molecolare. E si sono chiesti: quali geni dell'intero DNA umano, presenti naturalmente in ogni cellula del plesso coroideo, sono espressi (usati) specificamente nel plesso coroideo sano e in quello malato? Tecnicamente, hanno usato alcune migliaia di cellule provenienti da ogni plesso coroideo e hanno visto l'espressione genica su micro-reti di 44.000 geni umani.
Sono emerse molte differenze molecolari tra plessi coroidei sani e quelli interessati dall'Alzheimer. Con tecniche avanzate di bioinformatica, hanno categorizzato questi geni espressi in modo differenziale nei percorsi molecolari rilevanti per l'Alzheimer.
Ad esempio, hanno scoperto che il gene Claudin 5 è meno espresso nei plessi coroidei interessati dall'Alzheimer, rispetto ai plessi coroidei sani. Poiché sappiamo che il Claudin 5 è il custode del trasporto paracellulare, i ricercatori hanno concluso che nell'Alzheimer la barriera BCSFB diventa più permeabile, se non addirittura perforata.
In sintesi lo studio ha scoperto che nell'Alzheimer:
- c'è un cedimento del plesso coroideo umano;
- sono compromesse varie funzioni normali della barriera BSCFB, compresa la produzione di CSF, l'eliminazione e il trasporto dell'Aß, e il funzionamento della barriera.
Lo studio ha fornito (in parte) lo sfondo molecolare di questi problemi e apre nuove strade per futuri modelli terapeutici razionali di questa malattia devastante.
Fonte: Atlas of Science (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Arthur A. Bergen, Sovann Kaing, Jacoline B. ten Brink, Theo G. Gorgels, Sarah F. Janssen and The Netherlands Brain Bank. Gene expression and functional annotation of human choroid plexus epithelium failure in Alzheimer’s disease. BMC Genomics 2015, 16:956. doi:10.1186/s12864-015-2159-z
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV