Una scoperta sorprendente, che ribalta decenni di pensiero sul modo in cui il corpo ripara le proteine mal ripiegate, espande notevolmente le opportunità di terapie per prevenire malattie come l'Alzheimer e il Parkinson, che sono collegate all'accumulo di proteine mal ripiegate nel cervello.
"Questa scoperta ci dà tutta un'altra prospettiva sulle malattie da ripiegamento delle proteine; un nuovo modo di inseguirle", ha detto Andrew Dillin, docente emerito «Thomas e Stacey Siebel» di ricerca sulle cellule staminali al Dipartimento di Biologia Molecolare e Cellulare e ricercatore dell'Howard Hughes Medical Institute alla University of California di Berkeley.
Dillin, con i borsisti post-dottorato Nathan A. Baird e Peter M. Douglas della UC Berkeley e dei loro colleghi dell'Università del Michigan, del The Scripps Research Institute e della Genentech Inc., ha pubblicato i risultati dello studio oggi, 17 ottobre, sulla rivista Science.
Le cellule mettono molto impegno nell'impedire di disfarsi alle proteine (che sono come un filo di perle disposte in una forma tridimensionale precisa), dal momento che l'attività di una proteina, come un enzima o un componente strutturale, dipende dalla sua forma che deve essere adeguatamente sagomata e piegata. Ci sono almeno 350 chaperoni [ciceroni, guide] molecolari distinti che pattugliano costantemente la cellula per ripiegare le proteine mal ripiegate. Il calore è una delle principali minacce per le proteine, come dimostra la frittura di un uovo: l'albume bianco diventa opaco mentre le proteine si dispiegano e poi si aggrovigliano come spaghetti.
Shock termico
Per 35 anni, i ricercatori hanno lavorato all'interno dell'ipotesi che quando le cellule subiscono uno shock termico, come con la febbre, esse producono una proteina che innesca una cascata di eventi che mette in campo ancora più chaperoni per ripiegare le proteine che si stanno dispiegando, mettendo la cellula in pericolo di essere uccisa.
Quella proteina (HSF-1, cioè Heat Shock Factor-1) lo fa legandosi ai promotori a monte dei più di 350 geni di chaperoni, aumentando l'attività dei geni e lanciando l'esercito di chaperoni, che in origine erano chiamati «proteine da shock termico». L'iniezione di HSF-1 negli animali ha dimostrato non solo di aumentare la loro tolleranza allo stress da calore, ma di allungare anche la durata della loro vita.
Poichè l'accumulo di proteine mal ripiegate è stato implicato nell'invecchiamento e nelle malattie neurodegenerative come l'Alzheimer, il Parkinson e l'Huntington, gli scienziati hanno cercato dei modi per aumentare artificialmente l'HSF-1 al fine di ridurre le placche e i grovigli di proteine che alla fine uccidono le cellule cerebrali. A tutt'oggi, tali potenziatori hanno esteso la durata della vita degli animali da laboratorio, compresi i topi, ma hanno anche aumentato notevolmente l'incidenza di cancro.
La squadra di Dillin ha scoperto negli esperimenti sul verme nematode C.elegans che l'HSF-1 fa molto di più che scatenare il rilascio di chaperoni. Una funzione ugualmente importante, se non di più, è la stabilizzazione del citoscheletro della cellula, che è l'autostrada che trasporta rifornimenti essenziali - compresi i chaperoni guaritori - nella cellula. "Stiamo suggerendo che, piuttosto che aumentare l'HSF-1 per prevenire le malattie come la corea di Huntington, dovremmo cercare i modi per produrre meglio l'actina del citoscheletro", ha detto Dillin. Queste tattiche possono evitare gli effetti collaterali cancerogeni dell'aumento di HSF-1.
Dillin è condirettore del Paul F. Glenn Center for Aging Research, una nuova collaborazione tra l'UC Berkeley e la UC San Francisco sostenuta dalla Fondazione Glenn per la ricerca medica. I ricercatori del centro studieranno i molti modi in cui malfunzionano le proteine all'interno delle cellule, aprendo idealmente la strada a nuovi trattamenti per le malattie neurodegenerative.
Una cellula in guerra
Dillin paragona una cella che sta vivendo uno shock termico ad un paese sotto attacco. In una guerra, un aggressore prima taglia tutte le comunicazioni, come strade, treni e ponti, fatto che impedisce ai medici di curare i feriti. Allo stesso modo, lo shock termico interrompe l'autostrada del citoscheletro, impedendo ai chaperoni "medici" di raggiungere i pazienti, le proteine mal ripiegate. "Pensiamo che l'HSF-1 non solo produce più chaperoni, più medici, ma garantisce anche che le strade rimangono intatte per tenere tutto funzionale e assicurarsi che i supervisori possono raggiungere i soldati malati e feriti", ha detto.
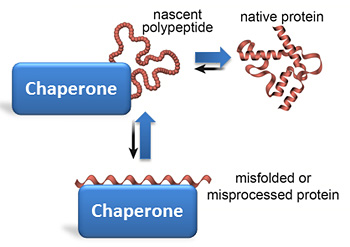 I chaperoni (guide, ciceroni) aiutano le proteine neonate (polipeptidi) a piegarsi correttamente, ma riparano anche le proteine mal ripiegate.
I chaperoni (guide, ciceroni) aiutano le proteine neonate (polipeptidi) a piegarsi correttamente, ma riparano anche le proteine mal ripiegate.
I ricercatori hanno scoperto in particolare che l'HSF-1 sovra-regola un altro gene (il pat-10), che produce una proteina che stabilizza l'actina, gli elementi costitutivi del citoscheletro. Potenziando l'attività del pat-10, sono riusciti a curare i vermi che erano stati modificati per esprimere il gene dell'Huntington, e hanno anche esteso la durata della vita dei vermi normali.
Dillin sospetta che la funzione principale dell'HSF-1 sia, in effetti, proteggere l'actina del citoscheletro. Lui e il suo team hanno mutato dell'HSF-1 in modo che non potesse più potenziare i chaperoni, dimostrando, ha detto, che "si può sopravvivere allo shock termico con un livello normale di proteine da shock termico, a patto di indurre il proprio citoscheletro a lavorare meglio".
Egli ha osservato che i risultati del team (= potenziare i chaperoni non è essenziale per sopravvivere allo stress da calore) erano talmente in contraddizione con il pensiero corrente che "per tre anni ho reso un inferno la vita ai miei post-dottorati", insistendo che facessero altri esperimenti per escludere errori. Eppure, quando di recente Dillin ha presentato i risultati ai membri della comunità di ripiegamento delle proteine, ha detto che la prima reazione di molti è stata: "Questo ha perfettamente senso".
*******
I colleghi di Dillin includono Milos S. Simic e Suzanne C. Wolff della UC Berkeley, Ana R. Grant dell 'Università del Michigan di Ann Arbor, James J. Moresco e John R. Yates III dello Scripps di La Jolla in California e Gerard Manning della Genentech di South San Francisco in California. Il lavoro è finanziato dall'Howard Hughes Medical Institute, dal National Institute of General Medical Sciences e dal National Institute on Aging dei National Institutes of Health.
Fonte: Robert Sanders in University of California - Berkeley (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: N. A. Baird, P. M. Douglas, M. S. Simic, A. R. Grant, J. J. Moresco, S. C. Wolff, J. R. Yates, G. Manning, A. Dillin. HSF-1-mediated cytoskeletal integrity determines thermotolerance and life span. Science, 2014; 346 (6207): 360 DOI: 10.1126/science.1253168
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV