Ricercatori dell'ESRF, il sincrotrone europeo, hanno scoperto che gli oligomeri amiloidi hanno un ruolo nell'accelerare l'energia mitocondriale durante le prime fasi dell'Alzheimer, in contrasto con ciò che si è trovato finora nei tessuti cerebrali con Alzheimer avanzato.
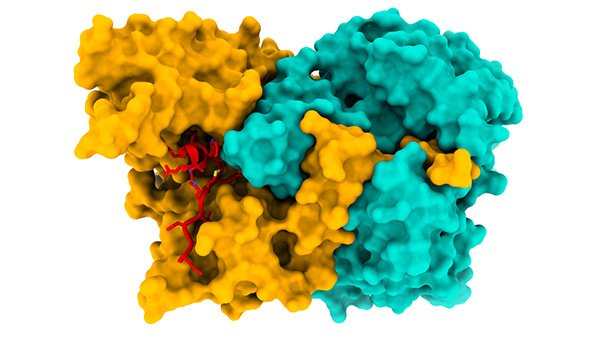 Struttura del complesso ACAD9-ECSIT_CTER (ECSIT in rosso), importante per il corretto funzionamento dei macchinari che producono energia nei mitocondri. Fonte: ESRF/M.Soler López
Struttura del complesso ACAD9-ECSIT_CTER (ECSIT in rosso), importante per il corretto funzionamento dei macchinari che producono energia nei mitocondri. Fonte: ESRF/M.Soler López
L'origine del morbo di Alzheimer (MA), che colpisce 30 milioni di persone in tutto il mondo, non è ancora chiara, nonostante gli sforzi di ricerca internazionali e i progressi significativi della ricerca. Eppure, è essenziale identificare i fattori che guidano questa malattia neurodegenerativa incurabile per trovare modi migliori per diagnosticarla, ritardare la sua insorgenza e prevenirne la progressione.
"Prima di comprendere la patologia, dobbiamo comprendere la biologia", spiega Montse Soler López, responsabile del gruppo di biologia strutturale dell'ESRF e autrice senior dello studio.
Il MA è una malattia incurabile che normalmente appare dopo i 65 anni, però i cambiamenti nel cervello iniziano 20 anni prima.
"Riteniamo che il malfunzionamento dei mitocondri possa avvenire 20 anni prima che la persona mostri i sintomi della malattia", spiega Soler López.
Per molto tempo, i ricercatori si sono concentrati sulle placche amiloidi nel cervello come potenziale causa della malattia, ma questa ipotesi è attualmente riconsiderata. Ora il team di Soler López, insieme alla scienziata Irina Gutsche dell'Institut de Biologie Strucurale (CNRS, CEA, Université Grenoble Alpes) e i ricercatori dell'EMBL, hanno in corso una nuova linea di ricerca incentrata su fattori dell'invecchiamento, come la disfunzione mitocondriale.
I mitocondri sono spesso indicati come la 'centrale energetica della cellula' per il loro ruolo essenziale nella produzione di energia. Nel tempo, i mitocondri soffrono di stress ossidativo e questo porta al loro malfunzionamento.
Una scoperta recente indica che gli individui con MA possono presentare un accumulo di amiloide all'interno dei mitocondri, sfidando la convinzione precedente che l'amiloide fosse presente esclusivamente all'esterno dei neuroni.
Durante le fasi iniziali del MA, l'amiloide esiste in genere sotto forma di oligomeri di amiloide-beta (Aβ) prima di trasformarsi in fibrille. La Soler López e il suo team indagano su ciò che accade nei mitocondri durante queste prime fasi.
L'energia è prodotta dai mitocondri attraverso la catena respiratoria, composta da cinque complessi proteici che devono operare in modo cooperativo ed efficace per generare energia. Tra questi, il Complesso I (CI) ha un'importanza significativa essendo l'enzima più grande e critico nella catena respiratoria.
Affinché il CI funzioni correttamente, sono essenziali i fattori di assemblaggio e il complesso del fattore di assemblaggio noto come Complesso I di Assemblaggio Mitocondriale (MCIA), che consiste di 3 proteine del nucleo (ECSIT, ACAD9, NDUFAF1) ha un ruolo centrale nel coordinare l'assemblaggio del CI per una funzionalità ottimale.
"Puntiamo a comprendere le interazioni tra il Complesso I e il complesso del fattore di assemblaggio durante le fasi iniziali dell'accumulo di amiloide, in particolare mentre si dipana nelle fasi pre-sintomatiche della malattia", spiega Lindsay McGregor, scienziata junior dell'ESRF e prima autrice della ricerca.
Gli scienziati hanno determinato la struttura del complesso ACAD9-ECSIT usando la microscopia a crioelettroni."Questa è una svolta, perché conoscere la struttura ci ha consentito di vedere in dettaglio le informazioni sul meccanismo di assemblaggio", spiega Soler López.
La Soler López e i suoi colleghi hanno scoperto che l'ECSIT ha un ruolo nel disattivare la funzione di ossidante degli acidi grassi di ACAD9 attraverso un processo di deflavinazione, reindirizzando la proteina al suo ruolo nell'assemblaggio di CI. Ciò è significativo per il coordinamento e la regolazione dei meccanismi di energia cellulare. Le loro osservazioni mostrano anche che un prerequisito per la corretta formazione di MCIA è una defosforilazione sito-specifica di ECSIT, dove la defosforilazione consente l'interazione ACAD9-ECSIT.
Risultati sperimentali nei mitocondri purificati hanno rivelato che la defosforilazione dell'ECSIT diventa più pronunciata in presenza di un accumulo di oligomeri di Aβ. A sua volta, questo accumulo di amiloide provoca iperattività del CI, in conformità con la maggiore stabilità di un complesso MCIA defosforilato che assiste la corretta formazione di CI.
Questi risultati divergono da studi precedenti su tessuti cerebrali di pazienti di MA, che avevano indicato lo spegnimento del CI. Soler López spiega:
"L'esatto contrario che osserviamo suggerisce che nelle prime fasi della malattia, gli oligomeri di Aβ stimolano l'iperattività del CI, creando un ciclo dannoso che alla fine porta alla compromissione della catena respiratoria. Questi risultati approfondiscono il ruolo degli oligomeri di Aβ all'inizio della malattia, aprendo potenzialmente nuove strade per affrontare il MA nelle fasi iniziali".
Fonte: European Synchrotron Radiation Facility (> English) - Traduzione di Franco Pellizzari.
Riferimenti: L McGregor, [+11], M Soler-Lopez. The assembly of the Mitochondrial Complex I Assembly complex uncovers a redox pathway coordination. Nature Commun, Dec 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV