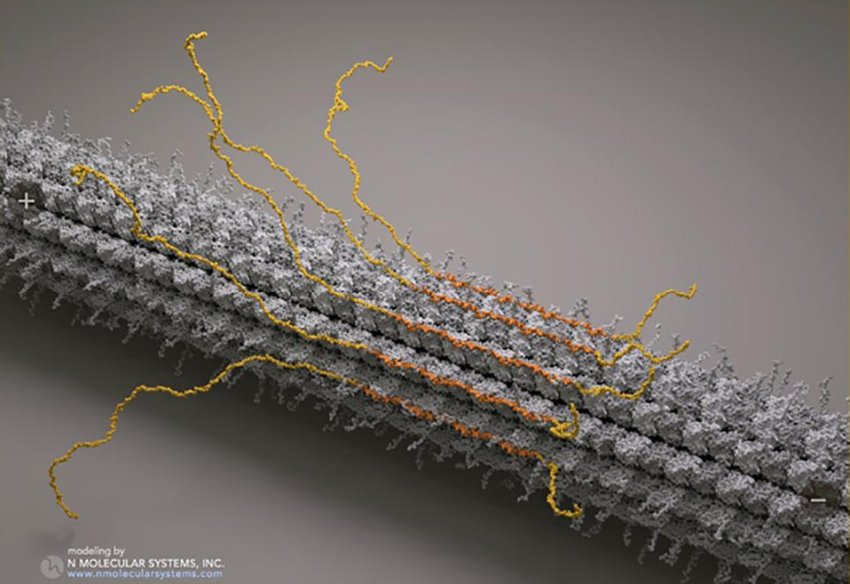
 La tau sana si riunisce come un involucro (arancione) attorno ai microtubuli all'interno della cellula. Un nuovo studio della UC Davis mostra che questo involucro stringe il microtubulo in una forma più compatta, cambiando il tipo di proteine che possono attaccarsi al microtubulo, e quindi regolando la funzione cellulare. Immagine: Molecular Systems Inc
La tau sana si riunisce come un involucro (arancione) attorno ai microtubuli all'interno della cellula. Un nuovo studio della UC Davis mostra che questo involucro stringe il microtubulo in una forma più compatta, cambiando il tipo di proteine che possono attaccarsi al microtubulo, e quindi regolando la funzione cellulare. Immagine: Molecular Systems Inc
Nel morbo di Alzheimer (MA) e in altre demenze neurodegenerative, le proteine che normalmente hanno un ruolo nel tessuto cerebrale sano diventano difettose, si raggruppano per formare placche e grovigli insolubili mentre i neuroni appassiscono e muoiono. Il modo esatto con cui queste proteine sono collegate alla malattia - e se possono essere puntate in qualche modo per rallentare, fermare o invertire la sua progressione - rimane un problema impegnativo.
Una nuova ricerca dell'Università della California di Davis, pubblicata il 22 agosto su Nature Chemical Biology, rivela un nuovo ruolo sul funzionamento di una di queste proteine, la tau, nelle cellule nervose sane, avvicinandoci a capire come potrebbe essere coinvolta nella patologia.
La proteina Tau è implicata in una vasta gamma di malattie neurodegenerative, ha affermato Kassandra Ori-McKenney, prof.ssa associata nel dipartimento di biologia molecolare e cellulare della UC Davis e autrice senior dello studio. Il cervello delle persone con MA contiene grovigli di proteina tau e placche di un'altra proteina, amiloide-beta. Tuttavia, i grovigli di proteine tau sono presenti anche in varie altre malattie, definite nell'insieme 'tauopatie' e in altre condizioni neurodegenerative, anche a seguito di lesioni cerebrali traumatiche.
Si pensava che la tau 'sana' esistesse come molecola proteica singola e che provocasse malattie quando si raggruppa ad altre proteine tau, formando i grovigli tau insolubili. Ma nel 2019, la Ori-Mckenney e Richard McKenney, prof. associato nello stesso dipartimento, hanno dimostrato che la tau sana potrebbe auto-associarsi e poi disassociarsi, rivelando che l'auto-associazione delle molecole tau potrebbe non necessariamente portare sempre alla patologia.
"Nella sua forma naturale, la tau può autoassemblarsi e disassemblarsi, quindi qual è il punto di non ritorno che produce la forma in cui non riesce più a disassemblarsi e forma un groviglio?", ha detto la Ori-McKenney.
Tau associata ai microtubuli
La tau fa parte di un gruppo di proteine presenti in tutti i tipi di cellule, dalle amebe a cellula singola agli insetti e alle persone, che si associano ai microtubuli, grandi filamenti proteici che riempiono l'interno delle cellule. I microtubuli costituiscono una infrastruttura all'interno della cellula che fornisce struttura e organizzazione, oltre a consentire agli elementi di muoversi all'interno della cellula e alla cellula stessa di muoversi. Affinché queste cose accadano, i microtubuli devono interagire con molte altre proteine.
Il loro studio del 2019 aveva mostrato che le molecole tau sane potevano riunirsi tra loro, formando un 'involucro' attorno ai microtubuli, un nuovo comportamento che gli autori hanno mostrato potrebbe avere un ruolo normativo rendendo più difficile o più facile, per altre proteine attaccarsi al microtubulo.
Nel nuovo studio, la Ori-McKenney, McKenney e dei collaboratori in Repubblica Ceca hanno condotto una serie di esperimenti con proteine tau e microtubuli isolati. Hanno scoperto non solo che la tau può autoassemblarsi per formare un involucro attorno ai microtubuli, ma che, quando lo fa, stringe il microtubulo in una forma più compatta. Può farlo perché i microtubuli sono costituiti da coppie (dimeri) di singole proteine di tubulina e resta un po' di schiacciabilità - circa 2 angstrom - tra i dimeri.
Ciò significa che la proteina tau può cambiare la compattazione lungo la lunghezza del microtubulo, il che a sua volta influenza il modo in cui altre proteine si attaccano ad essa. Ad esempio, la kinesina-1, una proteina motoria che può muoversi lungo i microtubuli, si attacca solo a un microtubulo non compatto.
Il team ha anche esaminato altre proteine che sono correlate evolutivamente alla tau, le 'proteine associate ai microtubuli' (MAP2 e 4). La MAP2, hanno scoperto, si comporta come la tau e può compattare i microtubuli, ma la MAP4 no. Questi risultati suggeriscono che tau e MAP2 potrebbero essersi evolute aumentando la loro capacità di compattare i microtubuli per funzioni specifiche all'interno delle cellule.
È interessante notare che entrambe le proteine si trovano in gran parte solo nel sistema nervoso, mentre la MAP4 si trova nella maggior parte dei tessuti del corpo, suggerendo che i ruoli di tau e MAP2 nella compattazione dei microtubuli può essere molto importante nei neuroni.
Né MAP2 né MAP4 sono note per essere associate a stati patologici. Nel lavoro futuro, i ricercatori sperano di capire i passi tra auto-assemblaggio di tau sana e grovigli irreversibili patologici e i ruoli di queste proteine in diversi organismi.
Fonte: Andy Fell in University of California - Davis (> English) - Traduzione di Franco Pellizzari.
Riferimenti: V Siahaan, ...[+9], Z Lansky. Microtubule lattice spacing governs cohesive envelope formation of tau family proteins. Nature Chemical Biology, 22 Aug 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV