Un consorzio europeo coordinato dall'Università di Ginevra mostra che una mutazione nella proteina ApoE cambia il trasporto dei lipidi nel cervello e potrebbe promuovere l'insorgenza dell'Alzheimer.
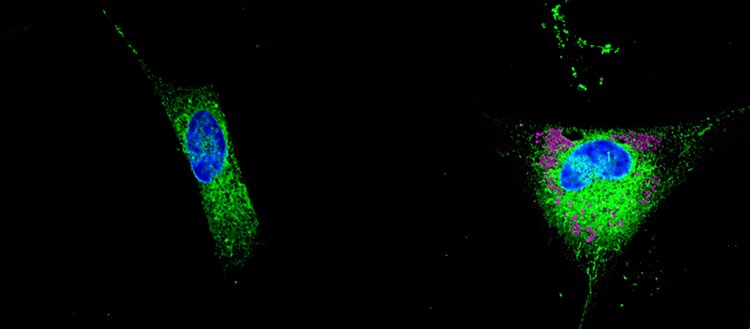 Sinistra: astrocita normale in grado di distruggere i lipidi tossici prodotti dai neuroni. Destra: un astrocita che immagazzina i lipidi in goccioline (rosa) e inizia a secernere lipidi tossici nel tessuto circostante. Fonte: ©Unige / A.C. Gavin.
Sinistra: astrocita normale in grado di distruggere i lipidi tossici prodotti dai neuroni. Destra: un astrocita che immagazzina i lipidi in goccioline (rosa) e inizia a secernere lipidi tossici nel tessuto circostante. Fonte: ©Unige / A.C. Gavin.
I neuroni nel cervello coesistono con, e si affidano a, molti altri tipi di cellule per funzionare correttamente. Gli astrociti, che prendono il nome dalla loro forma a stella, assicurano la sopravvivenza dei neuroni, nutrendoli e disintossicandoli con l'aiuto di una proteina multifunzione, l'ApoE.
Una delle tre forme di questa proteina, l'ApoE4, aumenta significativamente il rischio di sviluppare il morbo di Alzheimer (MA), ma i meccanismi in gioco erano finora sconosciuti. Una collaborazione tra l'Università di Ginevra (UNIGE), il Laboratorio Europeo di Biologia Molecolare, l'Università di Zurigo e la società farmaceutica Abbvie, ha scoperto un potenziale meccanismo: lontano dal cessare di funzionare, l'ApoE4 è al contrario più efficiente.
Innescando la secrezione astrocitica dei lipidi, provoca l'accumulo di lipidi potenzialmente tossici che sono dannosi per i neuroni, e quindi potrebbe contribuire allo sviluppo del MA. Questi risultati, pubblicati su Cell Reports, fanno nuova luce sui meccanismi neurodegenerativi di una malattia che colpisce circa 50 milioni di persone in tutto il mondo.
Gli astrociti, presenti in numeri molto grandi nel cervello, hanno una funzione protettiva importante. Queste cellule secernono l'apolipoproteina E (ApoE), una piccola proteina che forma particelle contenenti lipidi e vitamine per nutrire i neuroni. Disintossica anche i neuroni liberandoli dai 'rifiuti lipidici' che potrebbero diventare dannosi se non rimossi.
Poiché i neuroni non sono in grado di eliminare questi rifiuti da soli, l'ApoE entra in gioco per raccoglierli e riportarli agli astrociti dove sono distrutti. Il gene che codifica l'ApoE esiste in tre varianti frequenti nell'uomo: ApoE2, presente nell'8% della popolazione, ApoE3, il più comune e ApoE4, che si trova in quasi il 15% delle persone e aumenta di dieci volte il rischio di sviluppare il MA.
"Le ragioni per cui l'ApoE4 aumenta così tanto il rischio di MA non è chiaro", spiega Anne-Claude Gavin, prof.ssa nel Dipartimento di Fisiologia e Metabolismo Cellulare dell'UNIGE, che ha diretto questa ricerca insieme a Viktor Lakics, ricercatore di Abbvie.
Quali sono i meccanismi dietro la disfunzione dell'ApoE4? E soprattutto, potrebbero servire come base per la prevenzione o una terapia? Per rispondere a queste domande, Anne-Claude Gavin e la sua squadra hanno unito le forze con scienziati del Laboratorio Europeo di Biologia Molecolare, dell'Università di Zurigo e di Abbvie.
Una proteina troppo efficace
Lavorando su queste domande, il team di ricerca ha identificato nuovi meccanismi molecolari che spiegano che l'ApoE si lega alle membrane degli astrociti per rilevare ed estrarre i lipidi di cui ha bisogno.
Lavorando su linee cellulari umane con diverse varianti di ApoE, gli esperimenti in vitro hanno dimostrato che l'ApoE è molto efficiente nel trasporto di lipidi potenzialmente dannosi prodotti nei neuroni.
"E con nostra grande sorpresa, la variante ApoE4 si è rivelata ancora più efficiente delle altre forme", rivela Katharina Beckenbauer, ex postdottorato nel gruppo di Anne-Claude Gavin, scienziata senior di Abbvie e prima coautrice del lavoro. "Quindi, contrariamente a ciò che pensavamo fino ad ora, il problema non è che l'ApoE4 smetta di funzionare, ma, in realtà, è il contrario. E il meccanismo va fuori controllo".
Una funzione dirottata
Invecchiando, gli astrociti diventano meno efficienti e iniziano ad accumulare lipidi piuttosto che distruggerli.
"Abbiamo modellato sperimentalmente questo processo e osservato le molecole secrete dagli astrociti", spiega Karina Lindner, dottoranda nel laboratorio di Anne-Claude Gavin e altra prima coautrice di questo lavoro. "Abbiamo osservato che l'invecchiamento cellulare dirotta l'ApoE dalla sua funzione primaria (trasportare i lipidi ai neuroni e recuperare da loro i rifiuti lipidici) verso la secrezione dei trigliceridi, specie particolare di lipidi che potrebbero diventare dannosi se non rimossi".
E questo fenomeno è esacerbato con l'ApoE4, che stimola la secrezione dei trigliceridi, portando al loro accumulo incontrollato. Questo accumulo deleterio di lipidi potenzialmente dannosi potrebbe benissimo dare un importante contributo alla morte neuronale, un segno distintivo del MA.
"L'ApoE4 avrebbe quindi la capacità di accelerare il processo patologico nella malattia attraverso il meccanismo che abbiamo scoperto", riassume la Lindner.
Per comprendere meglio i dettagli dell'azione dell'ApoE e soprattutto della variante E4, gli scienziati dell'UNIGE desiderano ora determinare come è regolata la secrezione di questi lipidi potenzialmente dannosi, e se questa secrezione può essere rilevata nelle persone che soffrono di MA.
Fonte: Université de Genève (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Karina Lindner, Katharina Beckenbauer, Larissa van Ek, Kevin Titeca, Sherida de Leeuw, Khader Awwad, Franziska Hanke, Alla Korepanova, Vladimir Rybin, Elizabeth Louise van der Kam, Eric Mohler, Christian Tackenberg, Viktor Lakics, Anne-Claude Gavin. Isoform- and cell-state-specific lipidation of ApoE in astrocytes. Cell Reports, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV