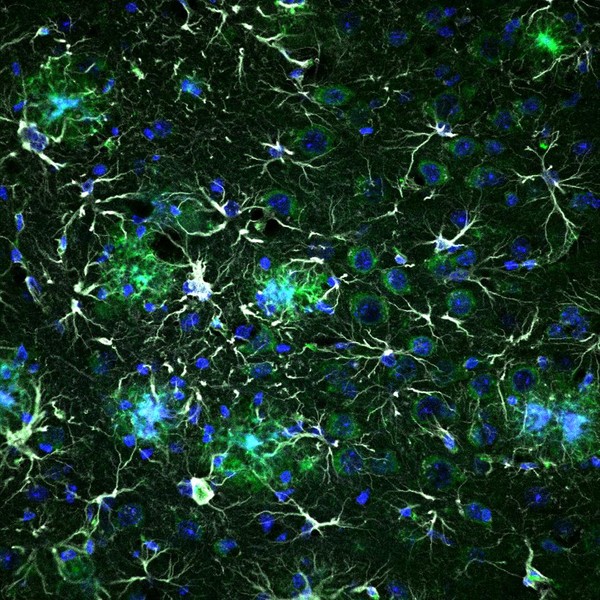
 Oltre ai neuroni, il cervello ospita vari tipi di cellule con funzioni specifiche, alcuni dei quali sono visibili in questa immagine (campione di tessuto di un topo con caratteristiche di Alzheimer). Gli astrociti (in bianco) supportano le funzioni dei neuroni e sono coinvolti nella regolazione del flusso sanguigno cerebrale. Nell'Alzheimer essi hanno forma e attività alterate. Questa immagine mostra anche il nucleo (blu) degli astrociti, dei neuroni e di altre cellule. Le strutture verdi nascono da una proteina associata all'Alzheimer. (Fonte: DZNE / A. Delekate, T. Schumacher, G. Petzold)Anche se la maggior parte di noi non ha mai sentito parlare di astrociti, nel cervello umano queste cellule sono quattro volte più abbondanti delle cellule nervose (neuroni).
Oltre ai neuroni, il cervello ospita vari tipi di cellule con funzioni specifiche, alcuni dei quali sono visibili in questa immagine (campione di tessuto di un topo con caratteristiche di Alzheimer). Gli astrociti (in bianco) supportano le funzioni dei neuroni e sono coinvolti nella regolazione del flusso sanguigno cerebrale. Nell'Alzheimer essi hanno forma e attività alterate. Questa immagine mostra anche il nucleo (blu) degli astrociti, dei neuroni e di altre cellule. Le strutture verdi nascono da una proteina associata all'Alzheimer. (Fonte: DZNE / A. Delekate, T. Schumacher, G. Petzold)Anche se la maggior parte di noi non ha mai sentito parlare di astrociti, nel cervello umano queste cellule sono quattro volte più abbondanti delle cellule nervose (neuroni).
Ora, un team guidato da ricercatori della Stanford University ha scoperto che gli astrociti, che svolgono molte funzioni indispensabili nel cervello, possono diventare un personaggio scellerato, distruggendo le cellule nervose e guidando probabilmente il tragitto di molte malattie neurodegenerative.
Lo studio, il cui primo autore è Shane Liddelow PhD, postdottorato di Stanford, è stato pubblicato online il 18 gennaio su Nature.
"Abbiamo capito che gli astrociti non sempre sono i bravi ragazzi", ha detto l'autore dello studio Ben Barres MD/PhD, professore di neurobiologia, biologia dello sviluppo e neurologia e scienze neurologiche. "Una loro versione aberrante compare con abbondanza sospetta in tutti i posti sbagliati dei campioni di tessuto cerebrale di pazienti con lesioni cerebrali e disturbi neurologici importanti, dall'Alzheimer, al Parkinson, alla sclerosi multipla. Le implicazioni per il trattamento di queste malattie sono profonde".
Barres, che ha trascorso trent'anni concentrato sulle cellule cerebrali che non sono le cellule nervose, ha definito i risultati "la scoperta più importante che il mio laboratorio abbia mai fatto". Barres ha detto che fino ad oggi l'industria farmaceutica ha per lo più puntato le cellule nervose, i neuroni. Ma possiamo curare una vasta gamma di disturbi del cervello bloccando la metamorfosi degli astrociti in cellule tossiche, o contrastando farmacologicamente la tossina killer dei neuroni che quasi certamente è secreta da quelle cellule nocive.
Il ruolo degli astrociti
Una volta ritenute semplici cellule riempitive, atte solo a impedire ai neuroni di muoversi quando corriamo, abbiamo ora capito che gli astrociti forniscono supporto e guida cruciali e efficaci ai neuroni, aumentando la loro sopravvivenza e plasmando le connessioni condivise tra di loro che definiscono la circuiteria labirintica del cervello. E' anche noto che lesioni cerebrali traumatiche, ictus, infezioni e malattie benigne possono trasformare gli "astrociti a riposo" in "astrociti reattivi" con caratteristiche e comportamenti alterati. Ma fino a poco tempo fa era una questione aperta il fatto che gli astrociti reattivi fossero angeli o diavoli.
Nel 2012, Barres e i suoi colleghi hanno risolto quell'ambiguità quando hanno identificato due tipi distinti di astrociti reattivi, che hanno chiamato A1 e A2. In presenza di LPS, un componente presente nelle pareti cellulari dei batteri, hanno osservato che gli astrociti a riposo, in un modo o in un altro, finiscono sempre per diventare A1, pronti a produrre grandi volumi di sostanze pro-infiammatorie. Gli A2 dall'altra parte, sono indotti dalla privazione di ossigeno nel cervello, che si verifica durante gli ictus. Gli A2 producono sostanze che supportano la crescita, la salute e la sopravvivenza dei neuroni nei pressi del sito di ictus.
Ciò ha sollevato due domande: Come vengono generati gli A1? E una volta che sono generati, cosa fanno? Il nuovo studio risponde a entrambe le domande. Nell'affrontare la prima domanda, lo studio ha dimostrato che le cellule cerebrali immunitarie microglia, note per attivarsi se esposte a LPS così come nella maggior parte delle lesioni e malattie cerebrali, iniziano a emettere fattori pro-infiammatori che cambiano il comportamento degli astrociti.
Fattori pro-infiammatori
In una serie di esperimenti su topi di laboratorio, gli scienziati hanno identificato tre fattori pro-infiammatori la cui produzione è potenziata dopo l'esposizione a LPS: TNF-alfa, IL-1-alfa e C1q. Nel cervello, tutte e tre queste sostanze sono secrete esclusivamente dalle microglia. Ognuna, di per sé, ha un parziale effetto A1-inducente sugli astrociti a riposo. Insieme, esse spingono gli astrociti a riposo in uno stato A1 a tutti gli effetti.
Successivamente, i ricercatori hanno confermato che gli A1 gettano a mare le qualità nutritive che avevano avuto come astrociti a riposo (virtù dimostrate dal gruppo di Barres come essenziali per la formazione e il funzionamento delle sinapsi) e diventano tossici per i neuroni.
Nei vertebrati, le cellule nervose chiamate 'cellule gangliari della retina' (RGC) inviano informazioni dalla retina ai centri di elaborazione visiva nel cervello. Le RGC possono prosperare in cultura, ma solo se accompagnate da astrociti. Gli scienziati hanno coltivato RGC di roditori sia con astrociti a riposo che di tipo A1 e hanno contato il numero di sinapsi risultanti. Le RGC coltivate in combinazione con A1 hanno prodotto solo la metà delle sinapsi di quelle coltivate con astrociti a riposo, e quelle che si sono formate non funzionavano molto bene.
Ulteriori esperimenti hanno dimostrato che gli A1 perdono la capacità degli astrociti a riposo di potare le sinapsi non più necessarie o non più funzionali e la cui esistenza continua mina la funzione efficiente del cervello. In effetti, quando i ricercatori hanno coltivato RGC sane con concentrazioni sempre più forti del brodo in cui gli A1 erano stati a bagno, alla fine quasi tutte le RGC erano morte. Questo e altri esperimenti hanno dimostrato che gli A1 secernono una tossina potente, che uccide i neuroni.
Lo stesso trattamento ha ucciso molti altri tipi di neuroni, inclusi sia i motoneuroni spinali che muoiono nella sclerosi laterale amiotrofica e quelli dopaminergici umani la cui perdita misteriosa è la causa del Parkinson. L'acqua di bagno degli A1 ha compromesso anche lo sviluppo di un'altra classe di cellule cerebrali non neuronali chiamate oligodendrociti, essenzialmente frittelle piene di grasso che si avvolgono intorno alle fibre nervose, fornendo l'isolamento elettrico che accelera la propagazione a lunga distanza dei segnali. La distruzione autoimmune degli oligodendrociti e del loro contenuto di grasso dà origine alla sclerosi multipla.
Bloccare la formazione di A1
In un altro esperimento, i ricercatori hanno reciso i nervi ottici dei roditori, un atto di solito letale per le RGC, le cui fibre uscenti, chiamate assoni, costituiscono il nervo ottico. Nel sistema nervoso centrale, il taglio degli assoni induce l'intero neurone a morire rapidamente, ma il motivo era misterioso. I ricercatori hanno determinato la causa: gli A1. Essi hanno osservato che questi astrociti reattivi si formano rapidamente dopo che gli assoni sono recisi, ma che, neutralizzando TNF-alfa, IL-1-alfa e C1q con anticorpi su queste tre sostanze, si impedisce la formazione di A1 e la morte delle RGC negli animali.
Infine, i ricercatori hanno analizzato campioni di tessuto cerebrale umano di pazienti con Alzheimer, Parkinson, Huntington, sclerosi laterale amiotrofica e sclerosi multipla. In ogni caso, hanno osservato un gran numero di A1 raggruppati di preferenza dove la malattia era più attiva. Ad esempio, nei campioni di pazienti di Alzheimer, era di tipo A1 quasi il 60% degli astrociti presenti nella corteccia prefrontale, un'area in cui la malattia prende un grande tributo. Poiché gli A1 sono altamente tossici sia per i neuroni che per gli oligodendrociti, questi risultati implicano con forza che la formazione di A1 contribuisce a guidare la neurodegenerazione in queste malattie.
Barres ha detto che è in corso il tentativo di identificare la neurotossina secreta dagli astrociti A1: "Siamo molto eccitati dalla scoperta degli astrociti reattivi neurotossici, perché questo implica che le lesioni acute della retina, del cervello e del midollo spinale e tutte le malattie neurodegenerative potrebbero essere molto più curabili di quanto pensiamo".
********
NB: Barres è co-fondatore della società di biotecnologie Annexon Biosciences che ha prodotto (e richiesto il brevetto di) un anticorpo inibitorio del fattore C1q. I farmaci per bloccare il TNF-alfa e l'IL1-alfa esistono già.
Fonte: Bruce Goldman in Stanford University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Shane A. Liddelow, Kevin A. Guttenplan, Laura E. Clarke, Frederick C. Bennett, Christopher J. Bohlen, Lucas Schirmer, Mariko L. Bennett, Alexandra E. Münch, Won-Suk Chung, Todd C. Peterson, Daniel K. Wilton, Arnaud Frouin, Brooke A. Napier, Nikhil Panicker, Manoj Kumar, Marion S. Buckwalter, David H. Rowitch, Valina L. Dawson, Ted M. Dawson, Beth Stevens, Ben A. Barres. Neurotoxic reactive astrocytes are induced by activated microglia. Nature, 2017; DOI: 10.1038/nature21029
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV