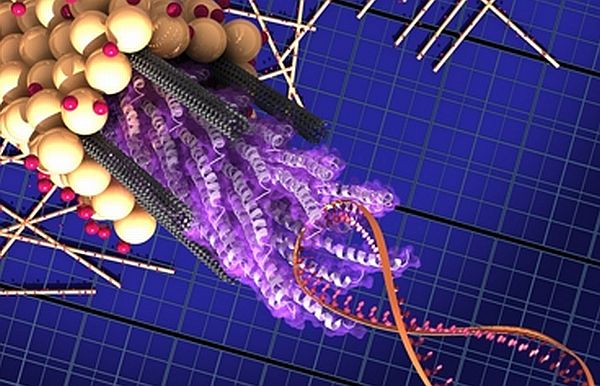
 Rappresentazione grafica del fago M13.
Rappresentazione grafica del fago M13.
Nel 2004, il chimico britannico Chris Dobson ha ipotizzato che ci potrebbe essere un elisir universale là fuori che potrebbe combattere contemporaneamente sia l'alfa-sinucleina del Parkinson, sia gli amiloidi causati da molte malattie da misfolding [errata piegatura] delle proteine.
Con non poca sorpresa, in quello stesso anno uno scienziato israeliano, di nome Beka Solomon, ha scoperto un candidato che sembrava improbabile per essere questo elisir, un microrganismo presente in natura chiamato «fago».
La Solomon, professoressa dell'Università di Tel Aviv, ha fatto una scoperta fortuita un giorno in cui stava provando una nuova classe di agenti contro l'Alzheimer. Se si proverà che funziona, potrebbe segnare l'inizio della fine dell'Alzheimer, del Parkinson, e di molte altre malattie neurodegenerative. E' una storia notevole, e il personaggio principale non è la Salomon o un qualsiasi altro scienziato, ma un virus umile che gli scienziati chiamano M13.
Fra le molte varietà di virus, ce n'è una che infetta soltanto i batteri. Questi microbi, chiamati batteriofagi, o semplicemente fagi, sono antichi (oltre tre miliardi di anni) e onnipresenti: sono presenti ovunque dal fondo dell'oceano allo stomaco umano. L'obiettivo del fago M13 è di infettare solo un tipo di batteri, l'Escherichia coli, o E.coli, presente in grandi quantità nell'intestino dei mammiferi. Come altri microrganismi, i fagi come l'M13 hanno un solo scopo: trasmettere i loro geni. Per farlo, hanno sviluppato delle armi che consentono loro di invadere, conquistare, e anche uccidere i loro ospiti batterici. Prima dell'avvento degli antibiotici, infatti, i medici a volte usavano i fagi per combattere le infezioni batteriche altrimenti incurabili.
Capire l'interesse della Salomon nell'M13 richiede la conoscenza di un po' di storia della sua ricerca. La Salomon è una ricercatrice importante di Alzheimer, rinomata per aver aperto la strada sui cosiddetti trattamenti di immunoterapia per la malattia. L'immunoterapia impiega anticorpi appositamente realizzati, piuttosto che farmaci a piccole molecole, per puntare le placche e i grovigli della malattia. Come apprendono gli studenti delle superiori nelle lezioni di biologia, gli anticorpi sono proteine a forma di Y che fanno parte della difesa naturale del corpo contro le infezioni. Queste proteine sono fatte per attaccarsi agli invasori e trattenerli, in modo che possano essere distrutti dal sistema immunitario. Ma dal 1970, i biologi molecolari sono riusciti a progettare geneticamente anticorpi umani, rendendoli idonei ad attaccare gli intrusi indesiderati, come le cellule tumorali. Nel 1990, la Solomon si proponeva di dimostrare che questi anticorpi artificiali potrebbero essere efficaci anche nell'attaccare le placche di amiloide-beta dell'Alzheimer.
Nel 2004, stava eseguendo un esperimento su un gruppo di topi che erano stati geneticamente modificati per sviluppare le placche della malattia nel cervello. Voleva vedere se gli anticorpi artificiali, introdotti attraverso i passaggi nasali degli animali, sarebbero riusciti a penetrare la barriera emato-encefalica e a sciogliere le placche di amiloide-beta nel cervello. Cercando un modo per far entrare più anticorpi nel cervello, ha deciso di attaccarli a dei fagi M13, nella speranza che i due agissero di concerto per penetrare meglio la barriera emato-encefalica, sciogliere più quantità di placca, e migliorare i sintomi dei topi, misurati dalla loro capacità di girare nel labirinto e di eseguire attività simili.
La Solomon ha diviso i roditori in tre gruppi. Ha dato l'anticorpo ad un gruppo. Il secondo gruppo ha avuto una combinazione di fagi-anticorpi, che secondo lei avrebbe avuto un effetto maggiore nel sciogliere le placche. E come controllo scientifico, il terzo gruppo ha ricevuto il fago M13 normale.
Poiché l'M13 non può infettare un qualsiasi organismo ad eccezione dell'E.coli, lei aveva previsto che il gruppo di topi di controllo non avrebbe avuto alcun beneficio dal fago. Ma, con sorpresa, il fago da solo si è dimostrato altamente efficace a sciogliere le placche amiloide-beta e nei test di laboratorio ha migliorato la cognizione e l'olfatto dei topi. Ha ripetuto l'esperimento più e più volte, con gli stessi risultati. "I topi hanno dimostrato un buon recupero della funzione cognitiva", dice la Solomon. E quando lei e il suo team hanno esaminato il cervello dei topi, le placche erano state in gran parte dissolte. Ha ripetuto l'esperimento per un anno e ha scoperto che i topi trattati con fagi avevano l'80% in meno di placche rispetto a quelli non trattati. La Salomon non capiva come un semplice fago poteva sciogliere le placche di Alzheimer, ma considerando la remota possibilità di essersi imbattuta in qualcosa di importante, ha deciso di brevettare le proprietà terapeutiche dell'M13 per l'Università di Tel Aviv. Secondo il figlio Jonathan, ha anche "ipotizzato il lancio di una nuova società basata sul fago, chiamata NeuroPhage. Ma non l'ha poi messa in pratica".
L'anno successivo Jonathan Solomon, che aveva appena finito più di dieci anni di servizio militare nelle forze speciali israeliane, durante i quali ha ottenuto una laurea in fisica e un master in ingegneria elettrica, è andato a Boston per iscriversi alla Harvard Business School. Mentre studiava per l'MBA, Jonathan continuava a pensare al fago che sua madre aveva esaminato e al suo potenziale per il trattamento di malattie terribili come l'Alzheimer. Ad Harvard, ha incontrato molti brillanti aspiranti imprenditori, tra cui Hampus Hillerstrom, di origine svizzera che, dopo aver studiato all'Università di San Gallo vicino a Zurigo, aveva lavorato per una società europea di biotech chiamata HealthCap.
Dopo il primo anno di scuola di amministrazione, entrambi gli studenti hanno vinto degli stage estivi: Solomon dal produttore di dispositivi medici Medtronic e Hillerstrom dal gigante farmaceutico AstraZeneca. Ma, come ricorda Hillerstrom, sono tornati a Harvard con la voglia di fare di più: "Avevamo entrambi passato un'estate ... diciamo 'strana', in grandi aziende, e ci siamo detti l'un l'altro: «Bene, dobbiamo fare qualcosa di più dinamico e più interessante»".
Nel secondo anno di MBA, Salomon e Hillerstrom hanno frequentato insieme un corso in cui gli studenti avevano il compito di creare una nuova società sulla carta. Il corso, dice Solomon, "era chiamato studio sul campo, e l'idea era di esplorare una tecnologia o una nuova idea imprenditoriale da sè stessi, pur essendo guidati da un professore della Harvard Business School. Così, con Hampus sono uscito con l'idea di avviare una nuova società basata sul fago M13 come progetto per il corso. Alla fine di quel semestre, abbiamo sviluppato un mini piano industriale. Ed è riuscito così bene che abbiamo deciso che valeva la pena provare a realizzarlo per davvero".
Nel 2007, con 150 mila dollari per partire, prestati dai famigliari, è nata una nuova avventura, la NeuroPhage Pharmaceuticals. Dopo aver negoziato una licenza con l'Università di Tel Aviv per esplorare le proprietà terapeutiche dell'M13, Salomon e Hillerstrom hanno contattato degli investitori disposti a scommettere sui potenziali poteri terapeutici dell'M13. Nel gennaio 2008, avevano raccolto oltre 7 milioni di dollari e hanno iniziato ad assumere personale.
Il loro primo dipendente, il responsabile scientifico di NeuroPhage, è stato Richard Fisher, un veterano di cinque start-up biotecnologiche. Fisher ricorda la mancanza di convinzione quando ha sentito parlare del fago miracoloso. "Ma nella mia vita ho fatto sempre una questione di persone, e la prima volta che ho incontrato Jonathan e Hampus mi sono piaciuti. E ho pensato che entro un anno, più o meno, avremmo probabilmente potuto capire se c'era qualcosa di veramente valido in ciò, ma ero molto scettico".
Fisher ha deciso di ripetere gli esperimenti con i topi di Beka Salomon e ha scoperto, pur con qualche difficoltà, che poteva dimostrare che i fagi M13 scioglievano le placche di amiloide-beta, quando il fago viene introdotto attraverso i passaggi nasali dei roditori. Nel corso dei successivi due anni, Fisher e i suoi colleghi hanno poi scoperto qualcosa di totalmente inaspettato: l'umile virus M13 può anche sciogliere altri grovigli aggregati diversi dall'amiloide, come la tau presente nell'Alzheimer e anche le placche amiloidi associate ad altre malattie, compresa l'alfa-sinucleina (del Parkinson), l'huntingtina (dell'Huntington), e il superossido dismutasi (della sclerosi laterale amiotrofica). Il fago funzionava anche contro gli amiloidi delle malattie da prioni (una classe che comprende la malattia di Creutzfeldt-Jakob). Fisher e i suoi colleghi hanno dimostrato questo prima in provetta e poi in una serie di esperimenti su animali. Sorprendentemente, sembrava che il semplice virus M13 avesse, in linea di principio, le proprietà di una "terapia completa", un elisir universale del tipo che aveva ipotizzato il chimico Chris Dobson.
La capacità unica di questo fago di attaccare bersagli multipli ha attratto nuovi investitori in un secondo round di finanziamento nel 2010. Solomon ricorda un mix di esuberanza e di dubbio: "Avevamo qualcosa di interessante che attaccava obiettivi multipli, ed era emozionante. Dall'altra parte, non avevamo idea di come lavorava il fago".
La chiave
Quello non era il loro unico problema. Il loro prodotto terapeutico, un virus vivo, hanno scoperto, era molto difficile da produrre. Non era nemmeno chiaro la quantità di particelle virali che doveva essere introdotta negli esseri umani. I metodi usati negli esperimenti su animali (inalazione attraverso il naso o iniezione direttamente nel cervello) erano inaccettabili, quindi la migliore opzione disponibile sembrava essere una cosiddetta iniezione intratecale nel canale spinale. Come dice Hillerstrom, "Era come una epidurale; questo era il percorso con cui avevamo deciso di introdurre il nostro virus".
Mentre Solomon e Hillerstrom si preoccupavano come trovare un percorso accettabile di somministrazione, Fisher passava lunghe ore a cercare di capire il meccanismo di azione sottostante del fago. "Perché un fago dovrebbe fare questo alle fibre amiloidi? E non avevamo davvero una idea precisa, tranne che al microscopio elettronico il fago assomigliava un po' a una fibra amiloide; aveva le stesse dimensioni".
Boston è una città con enormi risorse scientifiche. A meno di un miglio di distanza dagli uffici della NeuroPhage c'era il MIT, un centro mondiale di scienza e tecnologia. Nel 2010, Fisher ha reclutato Rajaraman Krishnan (studente indiano post-dottorato che lavorava in un laboratorio del MIT dedicato al misfolding proteico) per indagare sul puzzle del M13. Krishnan dice di essere stato subito affascinato. Il giovane scienziato ha iniziato a sviluppare alcuni nuovi strumenti biochimici per studiare come lavora il virus e ha anche divorato la letteratura scientifica sui fagi. Ha scoperto che gli scienziati sapevano molto sull'umile fago M13. I virologi hanno addirittura creato biblioteche di forme mutanti dell'M13. Con una serie di esperimenti per testare quali mutanti si legano all'amiloide e quali non lo fanno, Krishnan è riuscito a capire che le abilità speciali del fago coinvolgono un insieme di proteine che appaiono sulla punta del virus, chiamate GP3. "Abbiamo testato le diverse varianti per trovare esempi di fagi con o senza proteine sulla punta, e abbiamo scoperto che ogni volta che abbiamo pasticciato con le proteine della punta, abbiamo abbassato la capacità del fago di attaccarsi agli amiloidi", dice Krishnan.
I virologi, si è scoperto, avevano anche visualizzato le struttura del fago mediante cristallografia a raggi X e risonanza magnetica nucleare. Sulla base di questa analisi, i microbiologi avevano previsto che la modalità di funzionamento normale del fago in natura, è di schierare proteine della punta come chiavi molecolari; le chiavi in effetti consentivano al parassita di 'sbloccare' i batteri E.coli e iniettare il suo DNA. Nel 2011 Krishnan si è convinto che il fago stava facendo qualcosa di simile quando si legava ad aggregati amiloidi tossici. Il segreto dei poteri straordinari del fago, ha ipotizzato, giaceva completamente nella proteina GP3.
Come osserva Fisher, questo è fortuito. Proprio per "pura fortuna, le chiavi dell'M13 non solo sbloccano l'E.coli, ma funzionano anche sui ciuffi di proteine mal ripiegate". Le probabilità che ciò accada per caso, Fisher dice, sono molto piccole. "I virus hanno una squisita specificità nei loro meccanismi molecolari, perché sono in competizione tra loro ... e tutto deve essere a posto, e i due blocchi devono lavorare esattamente nel modo in cui sono stati progettati. E questo modo singolo di entrare nei batteri funziona anche per il legame con le placche amiloidi che causano molte malattie croniche del nostro tempo".
Dopo aver dimostrato che il segreto del virus risiede in alcune proteine della punta, Fisher, Krishnan e i loro colleghi si sono chiesti se potevano inserire il potere del fago di rompere l'amiloide in una medicina più facile da somministrare di una epidurale. Quindi nei successivi 2 anni, gli scienziati della NeuroPhage hanno progettato un nuovo anticorpo (una cosiddetta «proteina di fusione», perché è costituita da materiale genetico di fonti diverse) che presentava la proteina cruciale GP3 sulla superficie in modo che, come il fago, avrebbe potuto sciogliere le placche amiloidi. Fisher sperava che questo prodotto innovativo si sarebbe attaccato agli aggregati tossici, come faceva il fago.
Nel 2013 i ricercatori della NeuroPhage hanno testato il nuovo composto, che hanno chiamato NPT088, in provette e negli animali, inclusi i primati non umani. Hanno ottenuto risultati spettacolari, puntando contemporaneamente più proteine mal ripiegate come l'amiloide-beta, la tau, e l'alfa-sinucleina in diverse fasi di assemblaggio dell'amiloide. Secondo Fisher, il NPT088 non si attacca alle singole proteine piegate normalmente; infatti ha ignorato l'alfa-sinucleina normale. Si attacca solo alle proteine mal ripiegate, non solo dissolvendole direttamente, ma anche bloccando la trasmissione di tipo prionico, da una cellula all'altra: "Punta i piccoli aggregati, quegli oligomeri che alcuni scienziati ritengono essere tossici. E punta le fibre amiloidi che formano aggregati. Ma non si attacca alle singole proteine ripiegate normalmente". E come bonus, potrebbe essere introdotto per via endovenosa.
Gli esperimenti
C'era un brusio di eccitazione nell'aria quando ho visitato gli uffici della NeuroPhage a Cambridge nel Massachusetts, durante l'estate del 2014. I 18 dipendenti, tra cui Solomon, Hillerstrom, Fisher e Krishnan, erano fiduciosi che la loro nuova scoperta, che hanno chiamato piattaforma «General Amyloid Interaction Motif» (GAIM), potrebbe cambiare la storia. Dieci anni dopo che sua madre aveva fatto la scoperta fortuita, Jonathan Solomon stava finalizzando un piano per portare il prodotto in clinica. Come dice Solomon, "Ora abbiamo potenzialmente un farmaco che fa tutto ciò che poteva fare il fago, e che può essere somministrato sistematicamente ed è facile da produrre".
Funzionerà negli esseri umani? Mentre il NPT088, essendo costituito da molecole grandi, è relativamente debole nel penetrare la barriera emato-encefalica, il farmaco persiste nel corpo per diverse settimane, e così Fisher stima che nel tempo ne entra abbastanza nel cervello da rimuovere efficacemente le placche. Il concetto è che questo anticorpo può essere somministrato ai pazienti una o due volte al mese per infusione endovenosa, per il tempo necessario.
La NeuroPhage deve ora muoversi nel sistema di regolamentazione della FDA e dimostrare che il suo prodotto è sicuro ed efficace. Finora il NPT088 si è dimostrato sicuro nei primati non umani. Ma il grande test sarà la sperimentazione di fase 1A in programma quest'anno. Questo primo studio proposto sugli esseri umani è monodose, per cercare eventuali effetti negativi nei volontari sani. Se tutto va bene, la NeuroPhage avvierà uno studio di fase 1B che coinvolgerà circa 50 pazienti con Alzheimer, per ottenere la prova dell'attività del farmaco. I pazienti subiranno la scansione del cervello alla partenza, per determinare la quantità di amiloide-beta e di tau. Poi, dopo aver preso il farmaco per sei mesi, saranno sottoposti di nuovo alla procedura per vedere se il farmaco ha ridotto gli aggregati al di sotto della linea iniziale.
"Se il nostro farmaco funziona, lo scopriremo in questo esperimento", dice Hillerstrom. "E allora potremmo passare direttamente agli esperimenti di fase 2 sia per l'Alzheimer che per il Parkinson". Non c'è ancora nessun test di scansione per l'alfa-sinucleina, ma poiché il loro farmaco abbassa contemporaneamente i livelli di amiloide-beta, tau e alfa-sinucleina negli animali, un test di fase 1B di successo nell'Alzheimer può essere accettabile per la FDA. "Nei topi, lo stesso farmaco abbassa beta amiloide, tau e alfa-sinucleina", afferma Hillerstrom. "Pertanto, possiamo dire che se riusciremo a ridurre negli esseri umani la tau e l'amiloide-beta, in base ai dati sugli animali possiamo aspettarci di vedere una riduzione anche dell'alfa-sinucleina negli esseri umani".
Lungo la strada, l'azienda dovrà dimostrare che il suo sistema GAIM è superiore alla concorrenza. Al momento ci sono diverse aziende farmaceutiche e biotecnologiche che testano i prodotti in studi clinici per Alzheimer, sia contro l'amiloide-beta (Lilly, Pfizer, Novartis, e Genentech), che la tau (TauRx), e anche aziende con prodotti contro l'alfa-sinucleina per il Parkinson (Affiris e Prothena / Roche). Ma Salomon e Hillerstrom pensano di avere due vantaggi: la flessibilità multi-target (il loro prodotto è l'unico che può puntare più amiloidi in una sola volta) e la potenza (credono che il NPT088 elimini più aggregati tossici rispetto ai prodotti dei concorrenti). La potenza è un grosso problema. Le PET hanno dimostrato che i farmaci di Alzheimer esistenti, come il crenezumab, riducono i carichi di amiloide solo in misura modesta, circa del 10%. "Un punto debole dei prodotti esistenti", dice Salomon, "è che essi tendono a evitare solo i nuovi aggregati. C'è bisogno di un prodotto abbastanza potente da sciogliere gli aggregati esistenti. C'è bisogno di un prodotto potente, perché c'è molta patologia nel cervello e un lasso di tempo relativamente breve in cui trattarla".
Obiettivi futuri
L'ascesa di NeuroPhage è uno straordinario esempio di imprenditorialità scientifica. Anche se sto facendo tifo per Solomon, Hillerstrom e i loro colleghi, e sarei felice di essere volontario per uno dei loro esperimenti (mi è stato diagnosticato il morbo di Parkinson nel 2011), ci sono ancora molte ragioni per cui la NeuroPhage ha una strada difficile davanti. Il biotech è un business brutalmente rischioso. A pensarci bene, il NPT088 può risultare pericoloso. E può non essere comunque abbastanza potente. Anche se il NPT088 riduce in modo significativo amiloide-beta, tau, e alfa-sinucleina, è possibile che questo non possa portare a benefici clinici misurabili nei pazienti umani, come è successo nei modelli animali.
Ma se funziona, allora, secondo Solomon, il farmaco potrà davvero cambiare il mondo: "Un unico composto che tratta in modo efficace Alzheimer e Parkinson potrebbe essere un farmaco di grande vendita, da venti miliardi di dollari l'anno". E in futuro, un versione modificata potrebbe anche funzionare per la corea di Huntington, la SLA, le malattie da prioni come la malattia di Creutzfeldt-Jakob, e altro ancora.
Ho chiesto a Jonathan di sua madre, che ha lanciato questa straordinaria storia nel 2004. Secondo lui, è passata ad altre cose: "Mia madre, Beka Solomon, rimane un vero scienziato. Dopo aver fatto l'emozionante scoperta scientifica, lei è stata felice di lasciare a noi le cose meno interessanti, progettazione e commercializzazione. Lei sta cercando la prossima grande scoperta".
Fonte: Jon Palfreman in PBS/NovaNext (> English text) - Traduzione di Franco Pellizzari.
Testo estratto dal libro BRAIN STORMS: The Race to Unlock the Mysteries of Parkinson’s Disease di Jon Palfreman, pubblicato da Scientific American / Farrar, Straus and Giroux, LLC. Copyright © 2015 by Jon Palfreman. All rights reserved.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV