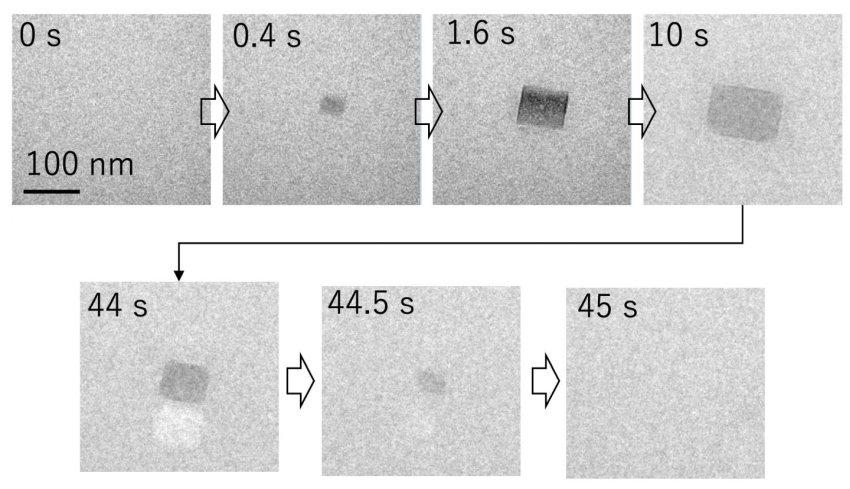
 Precipitazione-dissoluzione di un cristallo di sale osservata con la micrografia di stato liquido. (Fonte: Università di Osaka)
Precipitazione-dissoluzione di un cristallo di sale osservata con la micrografia di stato liquido. (Fonte: Università di Osaka)
Il morbo di Alzheimer (MA) è la prima causa di demenza in tutto il mondo e una delle principali ragioni di disabilità. Ora, ricercatori della Università di Osaka e della Hokkaido University hanno dimostrato che ci sono eventi ripetuti di precipitazione-dissoluzione di cristalli di sale, anche a basse concentrazioni di sale in scala nanometrica, che possono accelerare l'aggregazione dei peptidi neurotossici di amiloide-beta (Aβ) implicati nella sua patogenesi.
Il cervello umano è composto di circa 86 miliardi di neuroni, più o meno il numero di granelli di sabbia contenuti in un grande camion. Questi neuroni manipolano come segnali le informazioni elettrochimiche dentro il cervello, i muscoli e gli organi per orchestrare la sinfonia della vita, dalla sopravvivenza alla consapevolezza di sé.
Il MA distrugge questo complessa rete neuronale, causando disabilità funzionale e morte cellulare. Non essendoci ancora una cura, i trattamenti disponibili sono sintomatici, di supporto o palliativi; un passo avanti nella comprensione della sua patogenesi può rendere più chiare le prospettive per farmaci, diagnosi e prevenzione.
Il ruolo dell'Aβ nel MA è riconosciuto da tempo. I peptidi Aβ derivano dalla 'proteina precursore dell'amiloide' e si auto-assemblano in dimensioni che vanno da aggregati a basso peso molecolare, a oligomeri più grandi, a fibrille amiloidi. Queste ultime sono note per essere neurotossiche ma la ricerca recente suggerisce che anche gli aggregati oligomerici disordinati sono tossici, forse anche più delle fibrille.
"L'aggregazione delle fibrille inizia con la nucleazione, seguita da una fase di allungamento", spiega Kichitaro Nakajima, primo autore di questo studio. "Fino ad ora, le prime fasi di evoluzione degli oligomeri erano state difficili da studiare a causa della loro variabilità morfologica, dei tempi della nucleazione, e della mancanza di un test idoneo di fluorescenza".
Usando la microscopia elettronica con trasmissione allo stato liquido, i ricercatori hanno analizzato l'aggregazione delle molecole proteiche, l'acquisizione di immagini su scala nanometrica risolta nel tempo e gli schemi di diffrazione degli elettroni.
L'autore senior prof. Hirotsugu Ogi dice:
"Abbiamo scoperto la cosa importante che un cristallo di sale può precipitare anche ad una concentrazione molto inferiore alla sua solubilità, a causa della fluttuazione di densità locale, e la sua rapida dissoluzione accelera la reazione di aggregazione dei peptidi Aβ.
"Questa formazione di cristalli di sale temporanei fornisce un meccanismo mediante il quale le proteine aderiscono alla superficie del cristallo,. Come si scioglie, l'interfaccia si restringe, condensando le proteine al punto di evanescenza. Questo fenomeno assomiglia all'accelerazione di aggregazione da bolla di cavitazione ultrasonica.
"Durante la fase di espansione, le proteine sono attaccate alla superficie della bolla, e sono altamente condensate dai collassi successivi della bolla, dalla pressione positiva dell'onda ultrasonica al suo centro. Questo è l'effetto catalitico artificiale. Così, in un meccanismo di aggregazione nanoscopica di tipo autocatalitico, la dissoluzione del sale accelera la reazione di aggregazione, e l'aggregato in sé può promuovere la nucleazione del sale".
Ogi spiega le implicazioni di queste scoperte:
"L'aggregazione dei peptidi Aβ è lenta e questo è stato un ostacolo alla ricerca farmaceutica. Stabilire un metodo di accelerazione effettiva aiuterà a chiarire la loro evoluzione strutturale da monomero a fibrilla. Questa conoscenza è la chiave per capire la patogenesi del MA".
Fonte: Osaka University via EurekAlert! (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Kichitaro Nakajima, Tomoya Yamazaki, Yuki Kimura, Masatomo So, Yuji Goto, Hirotsugu Ogi. Time-Resolved Observation of Evolution of Amyloid-β Oligomer with Temporary Salt Crystals. J. Phys. Chem. Lett., 20 Jul 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV