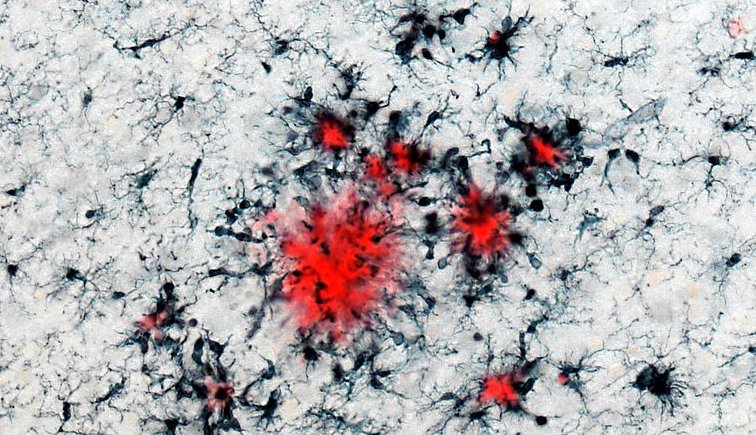
 Cellule immunitarie (in nero) raggruppate attorno alle placche di amiloide-beta (in rosso). Fonte: DZNE & HIH / Neher
Cellule immunitarie (in nero) raggruppate attorno alle placche di amiloide-beta (in rosso). Fonte: DZNE & HIH / Neher
Il neuroscienziato Michael Heneka sa che le idee radicali richiedono dati convincenti. Nel 2010, pochissimi colleghi condividevano la sua convinzione che il sistema immunitario del cervello ha un ruolo cruciale nella demenza. Così nel maggio di quell'anno, quando una serie di nuove scoperte ha fornito le prove della sua teoria, le più forti che aveva mai visto, voleva essere entusiasta, ma invece si sentiva nervoso.
Lui e il suo team avevano rimosso un gene chiave dell'infiammazione da un ceppo di topo che di solito sviluppa i sintomi del morbo di Alzheimer (MA). I topi modificati sembravano perfettamente sani. Sono passati attraverso test di memoria e hanno mostrato a malapena un segno di placche proteiche appiccicose che sono un segno distintivo della malattia. Eppure Heneka sapeva che i suoi colleghi avrebbero considerato i risultati troppo buoni per essere veri.
Persino lui fu sorpreso dal modo in cui andavano bene i topi; si aspettava che la rimozione del gene Nlpr3 avrebbe protetto un po' il loro cervello, ma non che si sarebbe avvicinato alla prevenzione dei sintomi della demenza. "Ho pensato che qualcosa fosse andato storto con gli esperimenti", dice Heneka, del Centro Tedesco Malattie Neurodegenerative di Bonn. Ha rianalizzato i risultati ancora e ancora. Era mezzanotte passata quando alla fine ha ammesso che potevano essere veri.
Nei due anni successivi, confermò che nulla era andato storto con gli esperimenti. Insieme ai suoi colleghi, ha replicato ed elaborato i risultati (1). Da allora, numerosi studi hanno rafforzato il legame tra la demenza e il sistema immunitario del cervello, evidenziando le cellule e i segnali coinvolti (2). Ma nessuno è riuscito a bloccarlo completamente; il collegamento sembra essere scivoloso e dinamico, cambiando con il progredire della malattia.
Anche così, l'idea ha suscitato l'interesse degli investitori farmaceutici, che vedono un mercato ampio e del tutto inutilizzato: circa 50 milioni di persone in tutto il mondo hanno la demenza, un numero che l'OMS proietta a 82 milioni entro il 2030. Degli 8 progetti di ricerca su farmaci finanziati dal Dementia Consortium - un gruppo di associazioni di beneficenza e farmaceutiche con sede nel Regno Unito che ha versato 4,5 milioni di sterline (5,1 milioni di euro) nei progetti - 4 sono finalizzati all'infiammazione.
Ma ci sono dei blocchi stradali più avanti. Gli scienziati non sono ancora d'accordo sul fatto che il sistema immunitario debba essere accelerato o ridotto a seconda delle diverse fasi della malattia. E alcuni dei problemi pratici che hanno perseguitato gli studi clinici nel MA (topi modelli imperfetti e difficoltà nel reclutare i pazienti abbastanza presto) possono affliggere anche questo nuovo approccio. Appesa sul campo come una nuvola nera è il fatto che tutti gli studi clinici sul MA hanno finora fallito.
Tuttavia, il bioinformatico Martin Hofmann-Apitius dell'Istituto Fraunhofer per Algoritmi e Calcolo Scientifico di Sankt Augustin, in Germania, specializzato nella ricerca farmaceutica, osserva che i ricercatori hanno depositato numerosi brevetti relativi agli obiettivi correlati all'infiammazione. "Presto vedremo un'ondata di studi clinici", prevede.
Intasato e gonfio
Lo psichiatra tedesco Alois Alzheimer fu il primo a descrivere i sintomi e la patologia della demenza, all'inizio del XX secolo. Guardando al microscopio al cervello di una donna del cui declino cognitivo era stato testimone, vide - e ordinatamente disegnò - le placche, che ora sappiamo sono composte di amiloide-β, e i grovigli di una proteina chiamata tau che insieme sono la firma della malattia. In quelle prime raffigurazioni del tessuto cerebrale affetto, Alzheimer disegnò anche le microglia, un tipo di cellula immunitaria nel cervello, annidata vicino ai neuroni. "Lo stesso Alzheimer ha notato le cellule e le ha disegnate in abbondanza insieme ai neuroni", dice Heneka.
Sebbene gli schizzi non stabilissero un legame più profondo tra microglia e malattia, Heneka li ha ricordati quando cominciarono a emergere i legami tra infiammazione e MA verso la metà degli anni '90. Era affascinato da alcune osservazioni epidemiologiche che mostravano che le persone che assumevano alcuni farmaci antinfiammatori (per trattare l'artrite reumatoide, per esempio) sembravano avere un rischio minore di sviluppare il MA rispetto alla popolazione generale.
È stato incoraggiato dai rapporti secondo cui le microglia si riuniscono attorno alle placche e alle aree di degenerazione cerebrale e che le molecole infiammatorie come le citochine si raccolgono nel liquido cerebrospinale dei pazienti. La maggior parte degli scienziati ha ipotizzato che queste osservazioni riflettessero una risposta passiva al danno tissutale. Ma Heneka ha sempre sospettato che l'infiammazione potesse provocare attivamente la malattia.
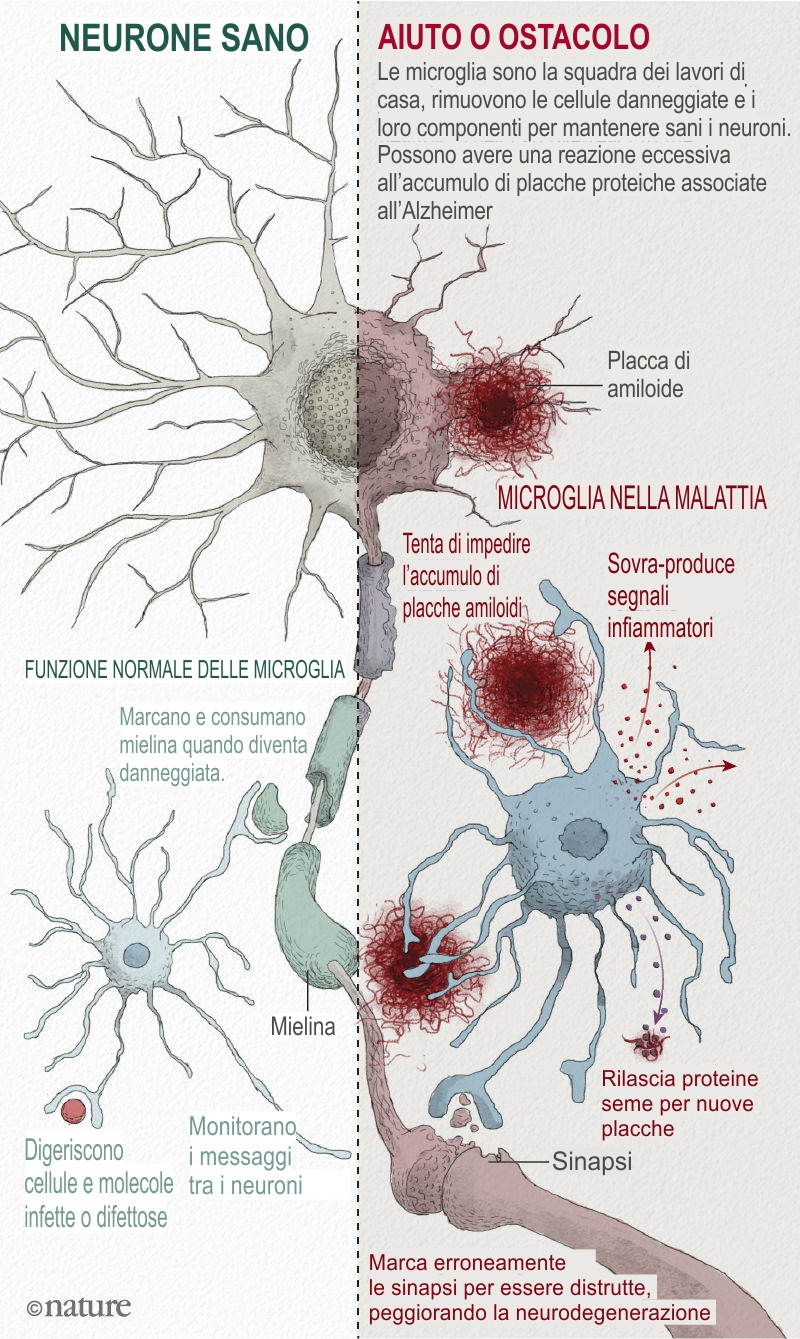
Le microglia si sono rivelate centrali per il legame tra infiammazione e neurodegenerazione (vedi 'Aiuto o ostacolo' nell'immagine sopra). Le cellule hanno due funzioni principali. Si prendono cura della salute generale dei neuroni e delle loro sinapsi, le giunzioni tra i neuroni dove comunicano tra loro. E pattugliano il cervello, alla ricerca di minacce e problemi. Quando rilevano una molecola infettiva o altrimenti-aberrante come l'amiloide-β (o detriti dalle cellule danneggiate), si attivano e segnalano ad altre microglia di unirsi a loro in uno sforzo di pulizia. Alcune proteine microgliali si riuniscono in grandi complessi chiamati inflammasomi (un componente chiave dell'inflammasoma è la proteina NLRP3 di Heneka), che produce segnali di pulizia sotto forma di molecole immunitarie attivate. Gli inflammasomi di solito diminuiscono una volta terminato il lavoro, ma nel MA sembrano rimanere attivi, continuando a pompare molecole infiammatorie senza riuscire a pulire adeguatamente.
Nel 2013, la microglia ha iniziato ad avere un grande ruolo nella ricerca sul MA. Più o meno nello stesso periodo in cui il documento di Heneka mostrava che prevenendo l'infiammazione si allontana la patologia di MA nei topi, il New England Journal of Medicine ha pubblicato due ampi studi sulle varianti geniche associate alla malattia (3,4). Entrambi gli studi hanno collegato il rischio di sviluppare il MA ad esordio tardivo a un gene chiamato TREM2, che produce una proteina presente nella membrana delle microglia.
I neuroscienziati hanno iniziato a prestare attenzione. Così come gli immunologi. Cresce una comunità interdisciplinare di neuroimmunologi. "All'improvviso si sono aperte enormi opportunità", afferma la neuroscienziata Michela Matteoli dell'Università di Milano, che ora gestisce un programma di neuroscienze nel dipartimento di immunologia del vicino Istituto Humanitas. All'Humanitas, ha trovato un tesoro di topi modello privi di elementi specifici del sistema immunitario, che gli immunologi non avevano mai avuto motivo di usare per studiare la funzione cerebrale. "Molti degli strumenti di cui abbiamo bisogno sono disponibili", afferma.
Eroine e furfanti
In che modo la microglia, che si è evoluta per mantenere il cervello in buono stato, diventa una forza maligna nel MA? L'anno scorso, Heneka e i suoi colleghi hanno pubblicato prove che suggeriscono un meccanismo plausibile della trasformazione, almeno nei loro topi. Hanno scoperto che le microglia attivate scartano i resti degli inflammasomi in piccoli gruppi chiamati granuli, e che questi granuli continuano a seminare nuovi ammassi di amiloide-β, diffondendo la malattia attraverso il cervello (5). "Una tempesta perfetta", dice Heneka. "L'amiloide-β tossico promuove l'infiammazione, che favorisce una maggiore tossicità dell'amiloide-β".
Egli sta collaborando con l'immunologo Eicke Latz, dell'Università di Bonn, per sviluppare un farmaco in grado di fermare la formazione dell'inflammasoma. Ciò consentirebbe alle microglia di continuare con gli altri ruoli importanti nella pulizia del cervello senza dover ricorrere ad altre microglia per aiutare a ripulire. La tempesta sarebbe tenuta a bada.
Latz ha co-fondato la start-up IFM Therapeutics a Boston, nel Massachusetts, nel 2016. La società, acquisita dalla società farmaceutica Bristol Myers Squibb lo scorso anno, ha già alcuni farmaci candidati che impediscono la formazione di inflammasomi e Latz e Heneka sperano di iniziare le sperimentazioni cliniche nei prossimi due anni.
Nel frattempo, i neuroimmunologi di tutto il mondo stanno cercando di acquisire una più profonda comprensione della biologia delle microglia, per capire se ci potrebbero essere altri modi per progettare terapie immunitarie per il MA e altre malattie neurodegenerative. Alcuni scienziati pensano che le attività salutari della microglia potrebbero essere rafforzate per eliminare l'amiloide-β tossica in modo più efficiente ed evitare del tutto la tempesta.
Due studi su topi e cervelli umani post-mortem hanno dimostrato che la microglia che si stringe intorno alle placche nel cervello è un sottogruppo molto specifico (6,7). Esprimono alcuni geni a livelli più alti o più bassi rispetto alla microglia normale, e questi modelli raccontano una storia interessante: le cellule sembrano cercare di mettere a punto i loro normali compiti di pulizia per combattere le placche. Alcuni di questi geni rimuovono le protezioni, o 'punti di controllo', dai percorsi che portano all'attivazione delle cellule. Altri sono in percorsi che avvertono un danno o incoraggiano la microglia a inglobare molecole difettose. In ogni caso, gli schemi di espressione genica indicano che le microglia stanno aumentando i loro doveri di riordino domestico per cercare di proteggere il cervello.
Le mutazioni in circa una dozzina di questi geni erano già state identificate come fattori di rischio per il MA negli esseri umani, dice Ido Amit, un immunogeneticista del Weizmann Institute of Science di Rehovot, in Israele, che ha condotto uno degli studi sui modelli di espressione genica (6).
Amit dice che le cellule sono chiaramente lì per una ragione e potrebbero quindi essere imbrigliate per aiutare. "I risultati sembravano darci un messaggio forte sulla biologia del sistema", dice. Se potessimo aiutare le microglia a svolgere le loro funzioni regolari in modo più efficiente, e impedire eventuali sforzi di pulizia eccessivi, ciò potrebbe aiutare a prevenire i sintomi della malattia piuttosto che peggiorarla.
Se c'erano ancora dubbi sull'importanza delle microglia nei meccanismi della demenza - che siano eroine o furfanti - questi documenti li hanno eliminati. Inoltre, le microglia potrebbero persino avere l'innesco per attivarsi dall'infiammazione in altre parti del corpo. Studi epidemiologici hanno dimostrato che l'onere dell'infezione durante la vita aumenta il rischio di deterioramento cognitivo o demenza in età avanzata (8,9). E all'inizio di questo mese, Jonas Neher del Centro Tedesco Malattie Neurodegenerative di Tubinga e i suoi colleghi hanno dimostrato che provocare l'infiammazione nei topi iniettando molecole chiamate lipopolisaccaridi (LPS) nella pancia porta a cambiamenti persistenti nell'espressione genica nella microglia del cervello, anche se le molecole stesse non entrano nel cervello. Le basse dosi di LPS hanno portato ad un aumento dei livelli di amiloide-β e placche; alte dosi hanno ridotto il peso (10).
La microglia potrebbe anche essere coinvolta in altre malattie neurodegenerative, poiché risultati simili sono stati osservati in modelli di sclerosi laterale amiotrofica (SLA) e morbo di Parkinson (11). E la ricerca di Matteoli e altri suggerisce che potrebbero essere implicati ancora più ampiamente nei disturbi cerebrali, come il raro disordine dello sviluppo neurologico noto come «sindrome di Rett» (12,13).
Riparo dalla tempesta
Amit sta ora discutendo con i partner industriali su come potenziare le attività di pulizia della microglia. "Questo ci permetterebbe di riattivare le nostre difese naturali quando il danno è fuori controllo", dice.
Altri temono che l'attivazione di più microglia nelle ultime fasi della malattia possa peggiorare le cose. "Non sappiamo ancora abbastanza della biologia", dice Oleg Butovsky, neuroimmunologo della Harvard Medical School di Boston, che ha condotto l'altro studio sull'espressione genica nelle microglia (7) e sta sviluppando biomarcatori per identificarle nel cervello in diverse fasi del disturbo. Dice che non è chiaro se le microglia debbano essere potenziate o soppresse, o anche se si possono usare tattiche diverse in momenti diversi durante la progressione della malattia.
E non tutti gli scienziati ritengono che il ruolo del sistema immunitario nella neurodegenerazione si fermi con le microglia. Il neurologo Philip De Jager della Columbia University di New York sta sviluppando una terapia di MA basata su un bersaglio microgliale, ma afferma che anche le cellule del resto del sistema immunitario del corpo, come le cellule T, presenti in numeri molto bassi nel cervello, potrebbero rivelarsi rilevanti.
Sebbene l'interesse clinico stia decollando, ci sono due elefanti testardi nella stanza: i topi modello usati nella ricerca sul MA sono un sostituto scadente della condizione umana, ed è difficile trovare persone che siano buone candidate per testare nuove terapie.
I topi con mutazioni geniche che li predispongono al MA sviluppano alcuni sintomi realistici, ma troppo rapidamente. Ciò lascia gli scienziati in difficoltà a identificare quando dovrebbe essere dato il trattamento. "I nostri modelli sono troppo accelerati", afferma Marco Colonna della Washington University di St. Louis, che ha lavorato a lungo sulla biologia del TREM2. "Il campo riconosce che è una priorità sviluppare un modello in cui l'amiloide si accumuli più naturalmente".
Una sfida è anche identificare le persone abbastanza presto nella progressione della loro malattia affinché qualsiasi farmaco sperimentale abbia la possibilità di funzionare. I ricercatori del MA ritengono che molti degli studi precedenti non abbiano avuto successo non perché la loro ipotesi - che amiloide-β e tau siano criticamente coinvolti nella malattia - non è corretta, ma perché il trattamento viene somministrato troppo tardi. I pazienti vengono generalmente reclutati in sperimentazioni solo dopo che il loro carico di placca e la neurodegenerazione sono progredite e la malattia è probabilmente irreversibile.
Questo potrebbe anche essere uno dei motivi per cui le sperimentazioni di farmaci antinfiammatori come il naprossene o il rofecoxib sono andate allo stesso modo di altri trattamenti potenziali e non hanno mostrato alcun beneficio nelle persone con MA, dice Heneka. Sono ora disponibili biomarcatori per identificare le persone che si trovano in una fase molto precoce della malattia. Anche così però i test sono molto costosi e ingombranti, coinvolgendo scansioni cerebrali e prelievi spinali. E hanno ancora bisogno di essere completamente convalidati nella pratica.
Le molte incertezze non stanno smorzando l'entusiasmo. "Sono stati alcuni anni interessanti", afferma De Jager. Gli scienziati sul campo vedono un parallelo con l'immunoterapia del cancro, in cui il sistema immunitario riceve una spinta per attaccare i tumori. "Sembra che le malattie non ritenute classicamente immunologiche possano effettivamente avere una base immunologica".
Quando Heneka ripensa ai suoi esperimenti con i topi inaspettatamente intelligenti, è cautamente ottimista sul fatto che le terapie basate sul sistema immunitario potrebbero funzionare per il MA. Ma i nuovi studi devono affrontare i problemi che hanno afflitto gli sforzi precedenti. Nessuno, dice, vuole vedere l'approccio fallire per le ragioni sbagliate. Poi, ancora una volta, non aveva mai visto un topo che avrebbe dovuto aver il MA superare il test con tali brillanti risultati.
Note:
- Heneka, M. T. et al. Nature 493, 674–678 (2013). Article
- Salter, M. W. & Stevens, B. Nature Med. 9, 1018-1027 (2017). Article
- Jonsson, T. et al. N. Engl. J. Med. 368, 107–116 (2013). Article
- Guerreiro, R. et al. N. Engl. J. Med. 368, 117–127 (2013). Article
- Venegas, C. et al. Nature 552, 355–361 (2017). Article
- Keren-Shaul, H. et al. Cell 169, 1276–1290 (2017). Article
- Krasemann, S. et al. Immunity 47, 566–581 (2017).Article
- Wallin, K. et al. J. Alzheimer’s Res. 31, 669-676 (2012). Article
- Bu, X.-L. et al. Eur. J. Neurol. 22, 1519–1525 (2015). Article
- Wendeln, A.-C. et al. Nature Article
- Yeh, F.L. et al. Trends Mol. Med. 23, 512-533 (2017). Article
- Tomasoni, R. et al. eLife 6, e21735 (2017). Article
- Derecki, N. C. et al. Nature 484, 105–109 (2012). Article
Fonte: Alison Abbott in Nature (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV