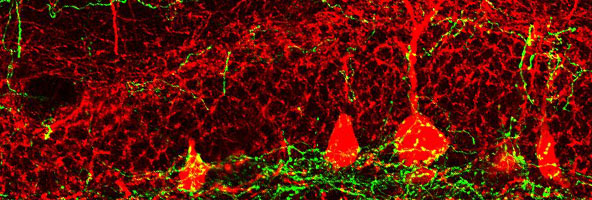
 Immagine co-focale che mostra una stretta associazione tra le proiezioni GABA mediali del setto-ippocampo e gli interneuroni PV locali dell'ippocampo. (Fonte: Laboratorio SONG)
Immagine co-focale che mostra una stretta associazione tra le proiezioni GABA mediali del setto-ippocampo e gli interneuroni PV locali dell'ippocampo. (Fonte: Laboratorio SONG)
Prima che nasciamo, il cervello in sviluppo crea un numero incredibile di neuroni, che migrano verso parti specifiche del cervello per prepararci alla vita.
Contrariamente alla credenza comune, la genesi di nuovi neuroni non si ferma alla nascita o addirittura nell'infanzia. In alcune aree specifiche del cervello, può continuare per tutta l'età adulta e si ritiene che sia vitale per alcune forme di apprendimento e memoria e nel regolamento dell'umore.
Non sappiamo ancora come è accesa e spenta la neurogenesi, ma i ricercatori della Università della Nord Carolina, guidati da Juan Song PhD, assistente professoressa del dipartimento di farmacologia, hanno appena trovato un indizio importante.
Nella ricerca, diventata notizia di copertina di Cell Stem Cell, i ricercatori hanno identificato un circuito cerebrale che controlla la neurogenesi, che corre da vicino alla parte anteriore del cervello all'ippocampo (una struttura correlata all'apprendimento e alla memoria). L'ippocampo è uno dei siti più importanti della neurogenesi nel cervello umano adulto e il circuito che il team della Song ha identificato regola questo processo che produce neuroni.
"Questo circuito controlla l'attività delle cellule staminali nella parte dell'ippocampo dove si manifesta la neurogenesi", ha detto la Song, membro del Centro Neuroscienze della UNC. "La nostra scoperta potrebbe avere implicazioni per capire e trattare molti disturbi cerebrali derivanti da una neurogenesi ippocampale aberrante, compresa l'epilessia, la schizofrenia, la depressione e l'Alzheimer".
Le cellule staminali neurali sono come le cellule staminali di altri tessuti e organi: fanno nascere, se necessario, nuove cellule che sostituiscono quelle morte o che stanno morendo. La maggior parte dei neuroni nel cervello adulto sono cablati strettamente in circuiti complessi e non vengono sostituiti.
L'eccezione principale è la regione del 'giro dentato' (GD) dell'ippocampo. La neurogenesi nel GD avviene durante la vita adulta e supporta le funzioni fondamentali dell'ippocampo nella memorizzazione e nel recupero di ricordi. La neurogenesi nel GD è stata collegata anche all'umore. In effetti, gli scienziati sospettano che gli effetti di miglioramento dell'umore dei farmaci antidepressivi e l'esercizio fisico nascono almeno in parte dalla spinta che essi danno alla neurogenesi nel GD.
Il modo in cui il cervello controlla la neurogenesi del GD, accelerandola o rallentandola quando è necessario, è un mistero che la Song e la sua squadra hanno cercato di risolvere fin dal momento che la Song ha fatto partire il suo laboratorio alla UNC nel 2013. In uno studio pubblicato nella rivista Nature Neuroscience, ad esempio, hanno scoperto che speciali neuroni ippocampali locali chiamati «interneuroni PV» forniscono segnali alla progenie neonata del GD che sembrano essere cruciali per una neurogenesi sana.
Nel nuovo studio, la Song e i colleghi hanno scoperto che questa segnalazione degli interneuroni-PV ippocampale è regolata da un circuito GABA proveniente dal setto mediale, un gruppo di neuroni vicino alla parte anteriore del cervello. "Questo circuito GABA del setto mediale funziona attraverso gli interneuroni PV locali dell'ippocampo per istruire le cellule staminali ad attivarsi o rimanere in silenzio", ha detto la Song. "Questo circuito GABA è unico, perché gli interneuroni PV locali sono eccitati dal GABA, un neurotrasmettitore del cervello che normalmente inibisce l'attività neuronale".
Quando una cellula staminale neurale viene attivata, inizia un processo di divisione cellulare che in ultima analisi produce nuovi neuroni che si collegano ai circuiti esistenti del cervello. In un ippocampo sano su un normale periodo di vita, la neurogenesi procede solo ad un livello basso. Le cellule staminali residenti rimangono per lo più in uno stato "dormiente" e la popolazione delle cellule staminali è mantenuta indefinitamente.
La Song e la sua squadra hanno scoperto che nei topi il circuito mediale setto-a-ippocampo funziona per mantenere le cellule staminali del GD in questo stato normale di bassa attività. Agisce come un freno sull'attivazione delle cellule staminali del GD e aiuta quindi a mantenere una popolazione sana di cellule staminali del GD.
Al contrario, interferire con questo circuito toglie completamente il freno, consentendo alle cellule staminali del GD di diventare non solo attive, ma anche troppo attive. In particolare, il team della Song ha scoperto che nei topi, questa sovra attivazione delle cellule staminali del GD causa una produzione eccessiva di nuovi neuroni e un massiccio esaurimento della popolazione residente di cellule staminali del GD. Inoltre, i nuovi neuroni prodotti in questa eccessiva esplosione di neurogenesi sembravano meno sani.
"Il loro aspetto era anomalo", ha detto la Song. "I loro dendriti - i gambi simili a radici che ricevono i messaggi dagli altri neuroni - erano troppo lunghi e avevano troppi incroci, suggerendo funzioni compromesse. È probabile che la produzione di questi neuroni anormali nell'ippocampo possa portare a deficit di apprendimento e di memoria".
Lei e la sua squadra ora vogliono determinare se il circuito mediale setto-a-ippocampo può essere mirato con terapie per proteggere le cellule staminali del GD e ripristinare la normale neurogenesi del GD nei casi in cui la neurogenesi stessa è anormale.
L'Alzheimer, la schizofrenia, la depressione e alcune forme di epilessia sono state collegate a deficit nella neurogenesi del GD. E' stato anche suggerito che l'Alzheimer coinvolge specificamente perdite dei neuroni del setto mediale che si collegano all'ippocampo per controllare la neurogenesi.
"In linea di principio, ripristinare i segnali normali dal circuito che collega il setto mediale all'ippocampo può offrire potenzialità terapeutiche per il trattamento di disturbi che implicano una neurogenesi anormale", ha detto la Song, che con il suo laboratorio sta attualmente studiando la funzione del circuito mediale setto-a-ippocampo nel contesto di topi modello di Alzheimer.
Fonte: University of North Carolina (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Hechen Bao, Brent Asrican, Weidong Li, Bin Gu, Zhexing Wen, Szu-Aun Lim, Issac Haniff, Charu Ramakrishnan, Karl Deisseroth, Benjamin Philpot, Juan Song. Long-Range GABAergic Inputs Regulate Neural Stem Cell Quiescence and Control Adult Hippocampal Neurogenesis. Cell Stem Cell, 2017; 21 (5): 604 DOI: 10.1016/j.stem.2017.10.003
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV