Un nuovo studio eseguito alla Iowa State University può aver identificato il collegamento che spiega anni di ricerca conflittuale su un gene mitocondriale e il rischio di Alzheimer (AD).
Auriel Willette, l'assistente professore di scienza alimentare e nutrizione umana che ha guidato lo studio, dice che il ricercatore che ha segnalato inizialmente il gene TOMM40 (Translocase of Outer Mitochondrial Membrane-40kD), ha scoperto che esso aumenta il rischio di Alzheimer. Tuttavia, Willette dice che, poiché altri studi non sono riusciti a replicare i risultati, molti ricercatori hanno ignorato la scoperta.
Non convinto che il gene fosse un fallimento totale, Willette ha deciso di esaminare gli altri fattori che potrebbero aver contribuito ai risultati contrastanti. Nella ricerca pubblicata online su Alzheimer & Dementia, insieme ai suoi colleghi ha trovato una drammatica differenza nell'impatto del gene sulla memoria, sulla funzione cognitiva generale e sul rischio, in base alla storia familiare di Alzheimer e alla lunghezza di una sezione specifica del gene.
"È stato come uno sparo al buio, ma abbiamo trovato se non hai una storia familiare di Alzheimer, allora una versione più lunga del gene è una cosa buona. È legata a una memoria migliore fino a 10 anni più tardi e a circa un quinto del rischio di Alzheimer", ha dichiarato Willette, che è anche assistente aggiunto di neurologia all'Università dello Iowa. "Tuttavia, se la mamma o il papà ha/aveva l'Alzheimer, allora la versione lunga è un male, è l'esatto contrario".
Nello studio, le persone alla fine della mezza età con una storia familiare e una versione più lunga del gene hanno avuto il doppio della perdita di memoria fino a 10 anni dopo di chi, pur con una storia familiare, aveva una versione corta del gene. Un risultato simile, ma più forte, è stato rilevato in un gruppo separato di anziani con e senza Alzheimer.
Per questo studio la storia familiare si limitava alla presenza di AD solo nei genitori del partecipante. Lo studio ha anche trovato un'associazione tra il gene, la storia familiare e la funzione dei mitocondri, che creano energia per alimentare le cellule. I ricercatori hanno controllato il sesso, l'età e l'istruzione nella loro analisi del TOMM40 e la storia familiare nei partecipanti allo studio.
Carburante per il cervello e perdita di memoria
Questo studio è l'ultimo pezzo del puzzle che Willette e i suoi colleghi stanno mettendo insieme nel tentativo di abbassare il rischio di Alzheimer e, infine, impedire alle persone di ottenere la malattia. La direzione complessiva del loro lavoro si concentra sul modo in cui il corpo trae e tratta l'energia, ha detto. Mentre questo studio esamina i mitocondri, Willette ha anche studiato la resistenza all'insulina e le proteine e gli enzimi che causano problemi che regolano l'energia.
Se separato, può essere più difficile cogliere l'impatto di ogni pezzo del puzzle o dello studio singolo. Nel complesso i ricercatori stanno imparando ciò che accade alla memoria e alla funzione cognitiva quando le cellule del cervello non hanno abbastanza energia per fare il loro lavoro, causando danni a lungo termine, ha dichiarato Willette. Con tutti questi diversi fattori, la sfida sta nell'indicare perché alcune persone contraggono l'Alzheimer e altre no.
"Come ricercatori, ci sembra di essere in un treno con mille diverse leve e pulsanti. Noi come comunità scientifica stiamo cercando di tirare ogni leva e spingere ogni pulsante per vedere quale è il freno", ha detto Willette. "Alla fine della giornata, tutto questo si fa per capire meglio come e quando nasce la malattia".
Identificare le modifiche prima delle fasi avanzate della malattia
Concentrarsi su questi problemi metabolici non sarebbe possibile senza anni di dati sugli individui con Alzheimer, in particolare i dati raccolti prima della loro diagnosi o dalle persone a rischio della malattia. Per questo studio, Willette ed i suoi colleghi hanno usato i dati del Wisconsin Registry for Alzheimer's Prevention e quelli della Alzheimer's Disease Neuroimaging Initiative. Il gruppo del Wisconsin segue i cambiamenti nella perdita di memoria e nella funzione cognitiva nel tempo per le persone di mezza età a rischio di Alzheimer, mentre l'altro gruppo segue analoghi cambiamenti nelle persone anziane con e senza la malattia.
Willette dice che, senza questi dati, i ricercatori avrebbero poca conoscenza della progressione della malattia. L'obiettivo è identificare i fattori unificanti che possono innescare la malattia analizzando i cambiamenti nel cervello, nel sangue e in altre aree del corpo. Con questo ultimo studio, Willette spera di aiutare i ricercatori di Alzheimer a mettere insieme altre risposte.
"È come cercare di risolvere il puzzle del sabato del New York Times, che può essere incredibilmente frustrante. Ma trovando la risposta corretta a una domanda, si può iniziare a compilare altre risposte", ha detto Willette. "Il mio augurio è che possiamo dare la risposta a quel cruciverba e che altri ricercatori possano trovare risposte aggiuntive basate su questo".
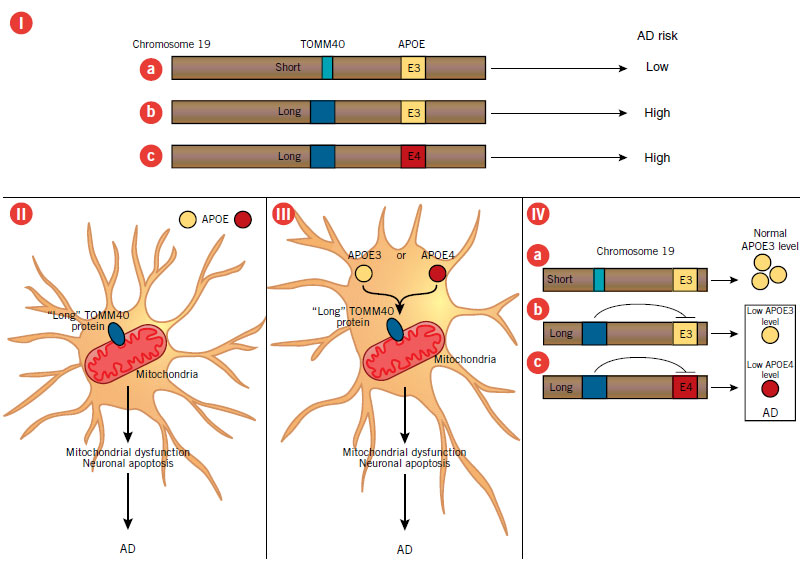 Alla conferenza internazionale sull'Alzheimer di Vienna in Luglio 2009, Allen Roses ha presentato la prova genetica che la variazione di lunghezza della sequenza all'interno del gene TOMM40 (translocase of outer mitochondrial membrane 40 homolog) influenza il rischio di AD. Il gene TOMM40, che codifica una proteina mitocondriale, si trova sul cromosoma 19, adiacente al gene che codifica l'apolipoproteina E (APOE), un fattore noto di rischio di AD. Il sequenziamento del DNA di 340 individui ha rivelato due forme di una regione non codificante all'interno del gene TOMM40.
Alla conferenza internazionale sull'Alzheimer di Vienna in Luglio 2009, Allen Roses ha presentato la prova genetica che la variazione di lunghezza della sequenza all'interno del gene TOMM40 (translocase of outer mitochondrial membrane 40 homolog) influenza il rischio di AD. Il gene TOMM40, che codifica una proteina mitocondriale, si trova sul cromosoma 19, adiacente al gene che codifica l'apolipoproteina E (APOE), un fattore noto di rischio di AD. Il sequenziamento del DNA di 340 individui ha rivelato due forme di una regione non codificante all'interno del gene TOMM40.
(I) La forma più comune contiene la ripetizione di una breve sequenza e si correla con un'età media di 78 anni dell'insorgenza di AD nei portatori dell'allele E3 dell'APOE [a] neutrale per l'AD, mentre una sequenza alternativa, ripetuta più a lungo, è correlata all'età media di insorgenza dell'AD di 70 anni nei portatori dell'E3 (n = 105, p <0.03) [b]. La forma lunga è presente anche in quasi tutti i portatori dell'allele E4 di APOE [c], che in precedenza Roses aveva dimostrato che si correla con una insorgenza precoce di AD.
Tre possibili meccanismi potrebbero spiegare il contributo di TOMM40 all'AD:
(II) APOE funziona al di fuori del neurone, separato fisicamente da una forma anomala di TOMM40. Il TOMM40 anomalo potrebbe portare a disfunzione mitocondriale, apoptosi e infine all'AD in modo indipendente dall'APOE.
(III) In alternativa, la proteina APOE intracellulare e la proteina TOMM40 potrebbero interagire sulla superficie mitocondriale per interrompere il metabolismo mitocondriale, portando ad apoptosi e AD.
(IV) Infine, la variazione di lunghezza nel gene TOMM40 potrebbe influenzare l'espressione del gene adiacente APOE. La forma breve di TOMM40 potrebbe portare a una forte trascrizione di APOE e quindi a livelli normali di proteine E3 che proteggono dalla malattia [a]. Tuttavia, la lunga forma di TOMM40 potrebbe smorzare l'espressione di E3 [b] o E4 [c], portando a livelli inadeguati di proteine APOE e successivamente all'AD.
(Fonte: SciBX, 6 Agosto 2009)
Fonte: Iowa State University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Auriel A. Willette, Joseph L. Webb, Michael W. Lutz, Barbara B. Bendlin, Alexandra M. Wennberg, Jennifer M. Oh, Allen Roses, Rebecca L. Koscik, Bruce P. Hermann, N. Maritza Dowling, Sanjay Asthana, Sterling C. Johnson for the Alzheimer's Disease Neuroimaging Initiative. Family history and TOMM40 ‘523 interactive associations with memory in middle-aged and Alzheimer's disease cohorts. Journal of Alzheimer' Disease, in press, DOI: 10.1016/j.jalz.2017.03.009
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV