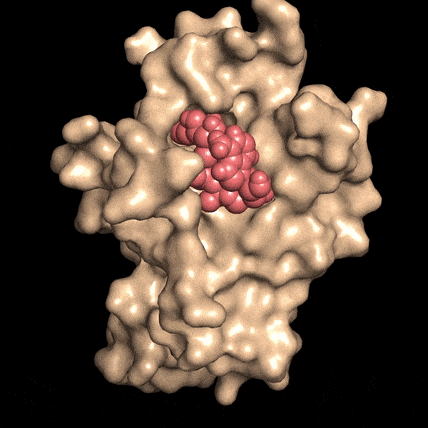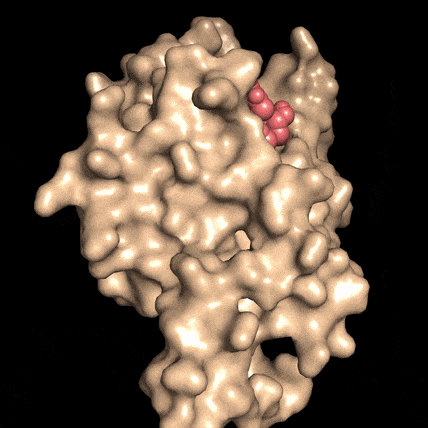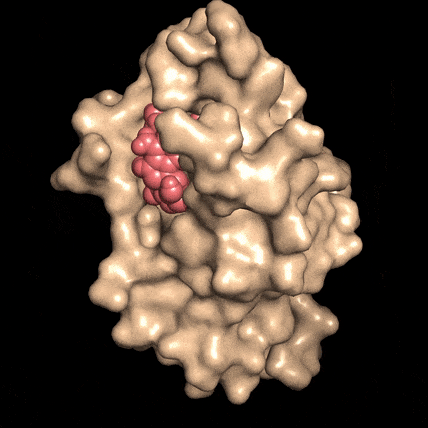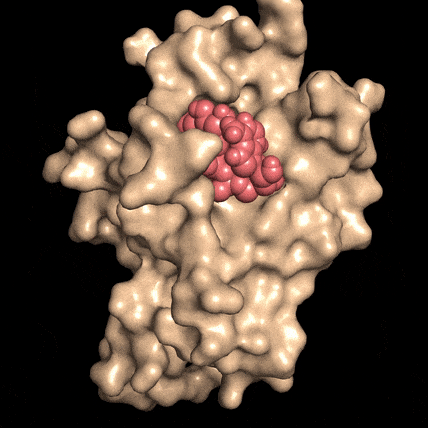
 Quando la molecola NAD (rosso), si lega alla proteina DBC1 (beige), le impedisce di attaccarsi, e di invalidare una proteina fondamentale per la riparazione del DNA. Fonte: David SinclairLa riparazione del DNA è essenziale per la vitalità cellulare, per la sopravvivenza delle cellule e per la prevenzione del cancro, ma la capacità delle cellule di mettere una pezza al DNA danneggiato diminuisce con l'età, per ragioni non ancora comprese.
Quando la molecola NAD (rosso), si lega alla proteina DBC1 (beige), le impedisce di attaccarsi, e di invalidare una proteina fondamentale per la riparazione del DNA. Fonte: David SinclairLa riparazione del DNA è essenziale per la vitalità cellulare, per la sopravvivenza delle cellule e per la prevenzione del cancro, ma la capacità delle cellule di mettere una pezza al DNA danneggiato diminuisce con l'età, per ragioni non ancora comprese.
Ora, una ricerca condotta da scienziati della Harvard Medical School rivela un passaggio fondamentale in una catena di eventi molecolari che permette alle cellule di riparare il loro DNA rotto.
I risultati, pubblicati oggi 24 marzo su Science, offrono una visione critica su come e perché la capacità del corpo di riparare il DNA diminuisce nel tempo e punta a un ruolo finora sconosciuto della molecola di segnalazione NAD come regolatore chiave delle interazioni tra proteine nella riparazione del DNA.
La NAD, identificata un secolo fa, è già nota per il suo ruolo come controllore dell'ossidazione dannosa delle cellule. Inoltre, esperimenti condotti su topi dimostrano che il trattamento con l'NMN, il precursore della NAD, mitiga il danno al DNA legato all'età e scongiura il danno al DNA provocato dall'esposizione alle radiazioni.
Gli scienziati avvertono che gli effetti di molte sostanze terapeutiche sono spesso profondamente differenti nei topi rispetto all'uomo, a causa delle differenze biologiche. Tuttavia, se riconfermati da ulteriori studi su animali ed esseri umani, i risultati possono contribuire a spianare la strada a terapie che prevengono il danno al DNA associato all'invecchiamento e a trattamenti contro il cancro che coinvolgono l'esposizione alle radiazioni e alcuni tipi di chemioterapia che, mentre uccidono i tumori, possono causare notevoli danni al DNA delle cellule sane. I test umani con la NMN dovrebbero iniziare entro sei mesi, secondo i ricercatori.
"I nostri risultati svelano un meccanismo chiave della degenerazione cellulare e dell'invecchiamento, ma oltre a questo puntano a un percorso terapeutico per arrestare e invertire i danni al DNA legati all'età e indotti da radiazioni", ha detto l'autore senior David Sinclair, professore del Dipartimento di Genetica di Harvard e dell'Università del New South Wales di Sydney in Australia. Uno studio precedente guidato da Sinclair aveva dimostrato che la NMN inverte l'invecchiamento muscolare dei topi.
Una trama con molti personaggi
Gli investigatori hanno iniziato esaminando un gruppo di proteine e molecole sospettate di avere un ruolo nel processo di invecchiamento cellulare. Alcune di loro erano personaggi ben noti, altre figure più enigmatiche.
I ricercatori sapevano già che la NAD, che diminuisce progressivamente con l'età, aumenta l'attività della proteina SIRT1, che ritarda l'invecchiamento e prolunga la vita del lievito, dei moscerini e dei topi. Sia SIRT1 che PARP1, una proteina nota per controllare la riparazione del DNA, consumano NAD nel loro lavoro.
L'altra proteina DBC1, una delle più abbondanti negli esseri umani, e presente in tutte le forme di vita, dai batteri alle piante e gli animali, era una presenza di gran lunga più nebulosa. Poiché la DBC1 aveva in precedenza dimostrato di inibire la SIRT1 che potenzia la vitalità, i ricercatori hanno sospettato che la DBC1 in qualche modo può anche interagire con PARP1, dati i ruoli simili di PARP1 e SIRT1.
"Abbiamo pensato che se c'è una connessione tra SIRT1 e DBC1 da un lato, e tra SIRT1 e PARP1 dall'altro, allora forse PARP1 e DBC1 sono anche impegnati in una sorta di gioco intracellulare", ha detto Jun Li, primo autore dello studio e ricercatore del Dipartimento di Genetica di Harvard. Lo erano.
Per capire meglio il senso del rapporto chimico tra le tre proteine, gli scienziati hanno misurato i marcatori molecolari dell'interazione tra di loro all'interno delle cellule renali umane. DBC1 e PARP1 si legano fortemente l'una all'altra. Tuttavia, quando aumentano i livelli di NAD, quel legame si interrompe. Più NAD è presente all'interno delle cellule, meno legami molecolari si formano tra PARP1 e DBC1. Quando i ricercatori hanno inibito la NAD, il numero di legami PARP1-DBC1 è salito. In altre parole, quando la NAD è abbondante, impedisce alla DBC1 di legarsi alla PARP1 e di immischiarsi nella sua capacità di riparare il DNA danneggiato.
Secondo i ricercatori questo suggerisce che, con il calo della NAD con l'età, ci sono sempre meno molecole di NAD in giro per fermare l'interazione dannosa tra DBC1 e PARP1. Il risultato: le rotture del DNA restano non riparate e, con l'accumulo nel tempo di queste rotture, accelerano i danni alle cellule, le mutazioni cellulari, la morte cellulare e la perdita della funzione dell'organo.
Invertire i danni
Quindi, per capire esattamente come la NAD impedisce alla DBC1 di legarsi alla PARP1, il team si è concentrato su un'area della DBC1 chiamata NHD, una struttura a tasca presente su circa 80.000 proteine di tutte le forme di vita e specie, la cui funzione ha eluso gli scienziati. Gli esperimenti del team hanno dimostrato che la NHD è un sito di legame della NAD e che nella DBC1, la NAD blocca questa regione specifica per impedire alla DBC1 di legarsi alla PARP1 e di interferire con la riparazione del DNA.
Sinclair ha aggiunto che, dal momento che la NHD è così comune tra le specie, la scoperta suggerisce che legandosi ad essa, la NAD può avere un ruolo simile nello scongiurare le interazioni delle proteine nocive in molte specie, per controllare la riparazione del DNA e altri processi di sopravvivenza delle cellule.
Per determinare come le proteine interagiscono al di là del piatto di laboratorio, negli organismi viventi, i ricercatori hanno trattato topi giovani e vecchi con NMN, il precursore della NAD, che costituisce la metà di una molecola di NAD. La NAD è troppo grande per attraversare la membrana cellulare, ma il NMN può facilmente scivolare attraverso di essa. Una volta all'interno della cellula, il NMN si lega ad un'altra molecola NMN per formare la NAD.
Come previsto, i topi vecchi avevano meno NAD nel fegato, livelli più bassi di PARP1 e un maggior numero di PARP1 con DBC1 attaccate alla schiena.
Tuttavia, dopo aver ricevuto NMN nell'acqua potabile per una settimana, i topi vecchi hanno mostrato marcate differenze sia nei livelli di NAD che nell'attività di PARP1. I livelli di NAD nel fegato dei topi vecchi sono schizzati a livelli simili a quelli dei topi giovani. Le cellule di topi trattati con NMN hanno anche mostrato una maggiore attività di PARP1 e meno molecole PARP1 e DBC1 legate insieme. Gli animali hanno mostrato un calo di marcatori molecolari che segnalano danni al DNA.
Nella fase finale, gli scienziati hanno esposto i topi a radiazioni che danneggiano il DNA. Le cellule di animali pre-trattati con NMN hanno mostrato livelli bassi di danno al DNA. Tali topi, inoltre, non hanno presentano le aberrazioni tipiche indotte da radiazioni alla conta ematica, come ad esempio il conteggio di cellule bianche alterate e i cambiamenti nei livelli di linfociti e di emoglobina. L'effetto protettivo è stato osservato anche in topi trattati con NMN dopo esposizione a radiazioni.
Nel loro insieme, i risultati mettono in luce il meccanismo alla base della morte cellulare indotta da danni al DNA. Essi inoltre suggeriscono che si dovrebbe esaminare più approfonditamente il ripristino i livelli di NAD attraverso il trattamento NMN come possibile terapia per prevenire gli effetti collaterali indesiderati delle radiazioni ambientali, nonché l'esposizione alle radiazioni da trattamenti contro il cancro.
In Dicembre 2016, un progetto collaborativo tra il Sinclair Lab e Liberty Biosecurity ha vinto la competizione iTech della NASA per il concetto di usare molecole che potenziano la NAD come potenziale trattamento dell'esposizione a radiazioni cosmiche durante le missioni spaziali.
[...]
Questo progetto di ricerca è stato dedicato alla madre di David Sinclair, Diana, che è sopravvissuta coraggiosamente il cancro per due decenni.
Fonte: Harvard University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Jun Li, Michael S. Bonkowski, Sébastien Moniot, Dapeng Zhang, Basil P. Hubbard, Alvin J. Y. Ling, Luis A. Rajman, Bo Qin, Zhenkun Lou, Vera Gorbunova, L. Aravind, Clemens Steegborn, David A. Sinclair. A conserved NAD binding pocket that regulates protein-protein interactions during aging. Science, 24 Mar 2017: Vol. 355, Issue 6331, pp. 1312-1317 DOI: 10.1126/science.aad8242
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV