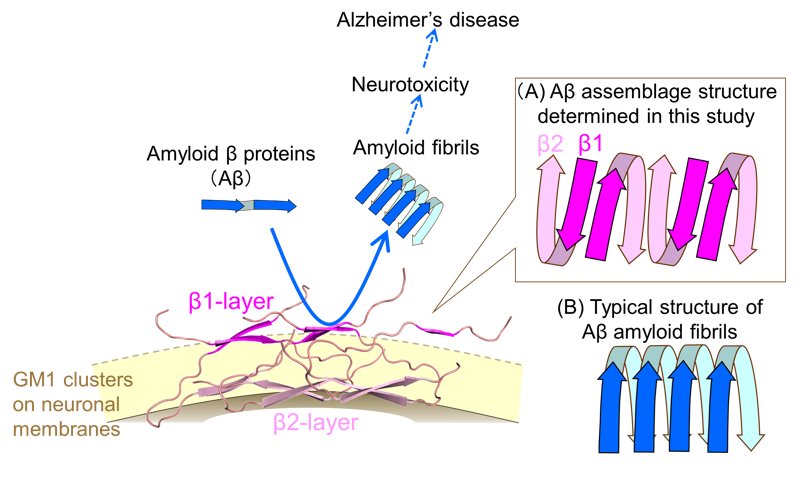
 (A) Sulla membrana dei neuroni, le molecole Aβ adottano una conformazione a forma di 'U', allineandosi alternativamente sulla superficie della membrana per formare due strati: lo strato β1, distante dalla membrana e lo strato β2, più vicino. Questo assemblaggio di Aβ funge da 'piattaforma catalitica', che accelera la fibrillazione delle molecole Aβ circostanti. (B) Nelle fibrille Aβ precedentemente riportate, le molecole Aβ si allineano nella stessa direzione.
(A) Sulla membrana dei neuroni, le molecole Aβ adottano una conformazione a forma di 'U', allineandosi alternativamente sulla superficie della membrana per formare due strati: lo strato β1, distante dalla membrana e lo strato β2, più vicino. Questo assemblaggio di Aβ funge da 'piattaforma catalitica', che accelera la fibrillazione delle molecole Aβ circostanti. (B) Nelle fibrille Aβ precedentemente riportate, le molecole Aβ si allineano nella stessa direzione.
I ricercatori del National Institutes of Natural Sciences (Giappone) e della Nagoya City University hanno raggiunto una svolta significativa chiarendo la struttura dell'amiloide-β (Aβ) legata ai glicolipidi sulla superficie delle cellule nervose. Questa scoperta fa luce sul ruolo critico della formazione anomala della fibrilla Aβ, un contributore importante del morbo di Alzheimer (MA) e promette progressi innovativi in medicina e farmacia.
Il MA è caratterizzato dall'aggregazione anormale di Aβ in fibrille amiloidi, che si accumulano nel cervello. Comprendere il meccanismo molecolare della formazione delle fibrille Aβ è cruciale nei campi della medicina e della farmacia. Per chiarirlo, i ricercatori si sono concentrati sull'interazione di Aβ con i glicolipidi chiamati gangliosidi GM1 sulla membrana dei neuroni.
Usando simulazioni con risonanza magnetica nucleare a stato solido e simulazioni di dinamica molecolare, il gruppo di ricerca ha rivelato che l'Aβ adotta una conformazione a forma di 'U' dopo essersi legata ai gangliosidi GM1 sulla superficie della membrana. Questa struttura dell'Aβ a forma di 'U' è costituita da due strati, il β1 (distale, cioè lontano dal centro, dalla membrana) e il β2 (più vicino alla membrana), disposti alternativamente (vedi figura in alto).
Contrariamente alle fibrille amiloidi Aβ riferite finora, che si allineano in direzione uniforme, l'assemblaggio di Aβ sulle membrane contenenti gangliosidi GM1 presenta una conformazione completamente diversa. In particolare, si è scoperto che lo strato β1, altamente esposto sulla superficie della membrana, funge da catalizzatore, accelerando significativamente la fibrillazione delle molecole Aβ circostanti. Inoltre, è emerso che gli anticorpi anti-GM1-Aβ riconoscono specificamente questa regione.
Questa ricerca è riuscita a svelare la struttura tridimensionale di Aβ, che funge da piattaforma catalitica per la formazione di fibrille amiloidi, in presenza di gangliosidi GM1 sulle membrane delle cellule neuronali. I vari anticorpi terapeutici sviluppati che puntano gli aggregati Aβ si legano principalmente alle fibrille amiloidi o ai loro precursori.
La struttura Aβ distinta, scoperta in questo studio, offre nuove possibilità in quanto gli anticorpi anti-GM1-Aβ sono in grado di riconoscere e legare questa conformazione unica. Di conseguenza, questa ricerca ha identificato per la prima volta l'entità strutturale responsabile della produzione di fibrille amiloidi nei tessuti cerebrali, offrendo potenzialmente informazioni sulla previsione del rischio di insorgenza del MA e aprendo percorsi per inibire la sua progressione.
La struttura tridimensionale delle molecole Aβ, come rivelata in questo studio, fornisce prospettive interessanti per lo sviluppo di nuove strategie terapeutiche contro il MA.
Fonte: National Institutes of Natural Sciences (> English) - Traduzione di Franco Pellizzari.
Riferimenti: M Yagi-Utsumi, [+4], K Nishimura. The Double-Layered Structure of Amyloid-β Assemblage on GM1-Containing Membranes Catalytically Promotes Fibrillization. ACS Chem Neurosci, 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV