Uno studio dell'Università di Osaka suggerisce un possibile meccanismo che collega il diabete all'Alzheimer, scoprendo che l'amiloide-β nel sangue proviene da organi periferici come il pancreas e il fegato, non solo dal cervello, e aiuta ad eliminare il glucosio del sangue inibendo la secrezione dell'insulina.
 Riassunto grafico della ricerca.
Riassunto grafico della ricerca.
Dei ricercatori hanno scoperto che l'amiloide-beta (Aβ) rilevata nel sangue proviene da tessuti periferici, e che il peptide agisce sulle cellule pancreatiche β per sopprimere la secrezione dell'insulina, regolando così i livelli di glucosio nel sangue. Lo studio, che ci spinge ad essere attenti quando si usano i livelli ematici di Aβ come marcatore diagnostico del morbo di Alzheimer (MA), è stato pubblicato su Proceedings of the National Academy of Sciences (PNAS).
“Questo lavoro è stato finalmente pubblicato dopo circa 11 anni”, dice il prof. Takami Tomiyama del Dipartimento di Neuroscienze Traslazionali della Osaka City University. “Non è solo una scoperta accademica, ma ha anche implicazioni nel modo in cui diagnostichiamo il MA”.
In base a ciò che sappiamo, questo studio ha cercato di esplorare alcune incognite:
- Primo, poiché il MA è causato da un accumulo di Aβ nel cervello, si pensa che i livelli di Aβ nel sangue riflettano la patologia nel cervello e sono attualmente usati come marcatore diagnostico. Tuttavia, l'Aβ è generata dalla proteina precursore dell'amiloide (APP) tramite la funzione di due enzimi, β- e y-secretasi, e questo meccanismo è espresso in molti tessuti periferici del corpo, non solo nel cervello, e questo fa si che l'origine dell'Aβ nel sangue rimanga sconosciuta.
- Secondo, studi epidemiologici hanno dimostrato che il diabete di tipo 2 è un fattore di rischio per lo sviluppo del MA, ma pure il meccanismo di collegamento tra queste due malattie ha eluso i ricercatori finora.
“Nei nostri studi precedenti su topi ai quali era stato iniettato glucosio”, spiega il prof. Tomiyama, “abbiamo trovato un aumento transitorio del glucosio e un picco di insulina a 15 minuti, ma i livelli di Aβ nel sangue arrivavano a picco circa 30-120 minuti più tardi”.
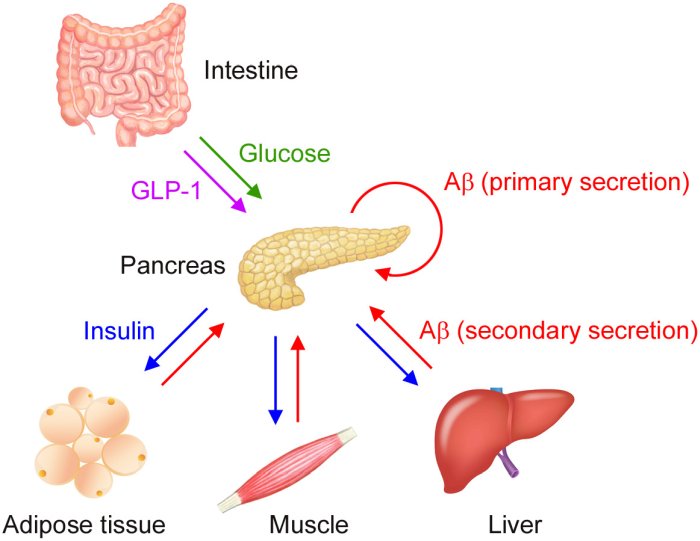
Inoltre, studi precedenti avevano dimostrato che la somministrazione orale di glucosio nel sangue aumenta i livelli di Aβ nei pazienti con MA. Questi risultati hanno portato il professore e il suo team a esplorare l'ipotesi che l'Aβ nel sangue sia secreto dai tessuti periferici (pancreas, tessuto adiposo, muscoli scheletrici, fegato, ecc.) e che possa contribuire al metabolismo del glucosio e dell'insulina.
Hanno iniziato esaminando gli effetti del glucosio e dell'insulina nel sangue sui livelli di Aβ in topi a digiuno per 16 ore. I campioni di sangue raccolti dalla vena della coda a intervalli di 0, 15, 30, 45, 60, 120, e 180 minuti dopo l'iniezione hanno mostrato un aumento transitorio del glucosio, dell'insulina e dell'Aβ, confermando gli studi precedenti.
Poi, hanno esplorato l'effetto dell'Aβ sui livelli di insulina nel sangue attraverso la somministrazione di Aβ e di glucosio a topi a digiuno che non potevano produrre Aβ (topi senza APP). La misurazione dell'insulina nei campioni di sangue nel tempo ha scoperto che l'Aβ ha soppresso l'aumento di insulina stimolato dal glucosio.
Dato che i livelli ematici di Aβ cambiavano immediatamente dopo l'introduzione di glucosio e di insulina, il team si è concentrato su pancreas, tessuto adiposo, muscoli scheletrici, fegato e reni dei topi e si è proposto di determinare l'origine dell'Aβ nel sangue. Hanno aggiunto glucosio e insulina a tessuti periferici isolati dal vivo e hanno misurato l'Aβ secreta.
I risultati hanno mostrato che l'Aβ era stata secreta dal pancreas su stimolo del glucosio e del tessuto adiposo, del muscolo scheletrico e del fegato a seguito della stimolazione insulinica. I reni, che non sono coinvolti nel metabolismo del glucosio o dell'insulina, non secernono Aβ su alcuna stimolazione. Hanno inoltre scoperto che quando glucosio e Aβ sono aggiunti al tessuto del pancreas, i livelli di insulina secreta sono soppressi.
Ora che era stata chiarita l'origine dell'Aβ nel sangue, il team ha voluto localizzare l'Aβ nei tessuti periferici studiati. Secondo il prof. Tomiyama:
“Questo chiarirebbe quali cellule sono coinvolte con l'Aβ. Oltre a fornire un'ulteriore convalida dei nostri risultati, questo ci darebbe un quadro più dettagliato dal quale possiamo trarre conclusioni sui possibili meccanismi che collegano il diabete di tipo 2 e il MA”.
Attraverso l'immunoistochimica che sfrutta il fatto che gli anticorpi si legano a determinate proteine, la squadra ha iniziato con il tessuto del pancreas, rilevando solo l'Aβ dell'insulina (cellule β). La squadra ha inoltre scoperto che le cellule ß di topi con iniezioni di glucosio avevano meno immunoreazioni all'Aβ e all'insulina, suggerendo che durante i periodi di digiuno, Aβ e insulina sono immagazzinati nelle cellule ß e poi rimesse in circolazione quando stimolate con glucosio.
Analogamente, sono state preparate sezioni di tessuto di ciascun organo puntato dall'insulina e immunomarcate per l'Aβ e sostanze bioattive specifiche per ciascun tessuto, chiamate organochine. L'Aβ è stata trovata nelle organochine di tutti i tessuti degli organi esaminati, con meno immunoreazioni quando stimolati con insulina.
“I nostri risultati suggeriscono che Aβ e organochine vengono immagazzinate durante i periodi di digiuno e rimesse in circolazione quando stimolate con insulina”, aggiunge il prof. Tomiyama. “In un futuro lavoro, ci auguriamo di chiarire meglio l'azione delle organochine dell'Aβ periferica".
Oltre a spiegare l'origine dell'Aβ nel sangue, i risultati della ricerca suggeriscono un meccanismo attraverso il quale il diabete di tipo 2 è un forte fattore di rischio per lo sviluppo di MA. Nel diabete, i livelli di Aβ nel sangue sono costantemente elevati a causa degli elevati livelli di glucosio e di insulina.
Ciò impedisce all'Aβ di lasciare il cervello per la periferia (con il trasporto attraverso la barriera emato-encefalica e dal flusso di fluido corporeo attraverso il parenchima cerebrale chiamato sistema glinfatico), provocando l'accumulo di Aβ nel cervello e lo sviluppo del MA.
“Si possono ricavare altri suggerimenti più pratici da questo studio”, conclude il prof. Tomiyama, “i nostri dati suggeriscono che, poiché i livelli di Aβ nel sangue variano significativamente con la dieta, si dovrebbe porre particolare attenzione nel diagnosticare il MA con l'Aβ nel sangue”.
Fonte: Osaka City University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Keiko Shigemori, S Nomura, T Umeda, STakeda, Takami Tomiyama. Peripheral Aβ acts as a negative modulator of insulin secretion. Proceedings of the National Academy of Sciences, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV