Ricercatori del Center for Brain Science (CBS) del Riken in Giappone hanno scoperto che la proteina α-endosulfina (ENSA) è coinvolta nello sviluppo dell'Alzheimer. Gli studi nei topi hanno dimostrato che eliminare questa proteina interamente o usare farmaci per bloccare la sua funzione riduce i cambiamenti fisici nel cervello associati alla malattia e migliora la memoria. La terapia farmacologica che mira a bloccare l'attività dell'ENSA potrebbe essere un trattamento più efficace di quello che è attualmente disponibile, oltre a essere più economico. Questo studio è stato pubblicato su Molecular Psychiatry.
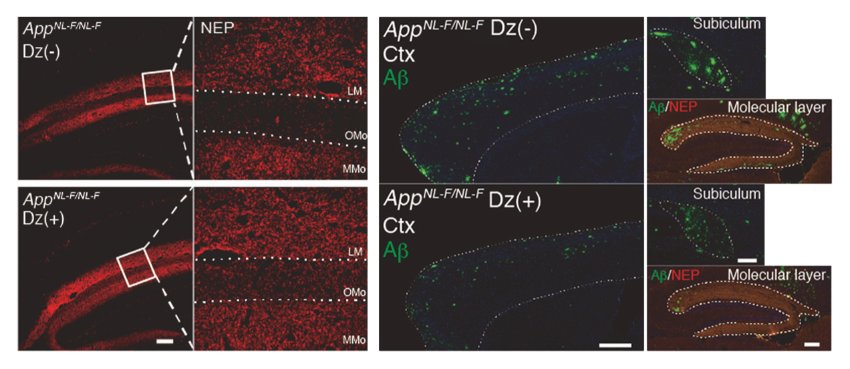 Livelli di neprilisina (rosso) e Aβ (verde) nell'ippocampo dei topi modello di Alzheimer. Sopra: controllo. Sotto: dopo essere stato nutrito con diazossido. Dopo il trattamento con diazossido, i livelli di neprilisina aumentano e i livelli Aβ diminuiscono.
Livelli di neprilisina (rosso) e Aβ (verde) nell'ippocampo dei topi modello di Alzheimer. Sopra: controllo. Sotto: dopo essere stato nutrito con diazossido. Dopo il trattamento con diazossido, i livelli di neprilisina aumentano e i livelli Aβ diminuiscono.
Il segno distintivo del morbo di Alzheimer (MA) nel cervello è l'accumulo del peptide amiloide-β (Aβ). Per anni, i ricercatori hanno cercato di determinare come e perché ciò accade. Takaomi Sato e il suo team al CBS del Riken hanno sviluppato un topo modello della malattia che mostra sia l'accumulo di Aβ che i deficit di memoria simili a quelli degli umani.
Con questo modello, hanno già scoperto una serie di eventi nel cervello che portano alla formazione di placche Aβ. In loro sono cruciali i livelli ridotti dell'enzima neprilisina, causati da livelli ridotti dell'ormone somatostatina. I livelli di neprilisina e di somatostatina scendono mentre invecchiamo, il che può spiegare perché il MA di solito colpisce le persone anziane.
Il nuovo studio si è concentrato sul trattamento del MA nei topi cercando di capire come la somatostatina controlla i livelli di neprilisina nel cervello. Secondo il primo autore Naoto Watamura, "il primo passo in questo processo è stato in realtà il più difficile perché abbiamo dovuto sviluppare un sistema in vitro per selezionare i regolatori della neprilisina in una sostanza condizionata generata da neuroni dell'ippocampo".
Una volta realizzato questo, è stato possibile identificare l'ENSA come il regolatore. I test hanno dimostrato che l'ENSA ha ridotto l'attività della neprilisina e che è salita a livelli anormalmente alti nel cervello dei topi carenti di somatostatina. Ciò significa che la somatostatina normalmente tiene sotto controllo l'ENSA, che a sua volta mantiene livelli alti di neprilisina, consentendo di distruggere l'Aβ prima che si accumuli.
Ora il team è concentrato sull'ENSA negli animali viventi. Usando la tecnologia CRISPR, hanno creato topi senza ENSA e poi li hanno allevati assieme ai topi modello di MA. L'accumulo di Aβ in questi nuovi topi è stato molto più basso rispetto ai topi del modello originale, indicando che livelli anormalmente elevati di ENSA potrebbero essere un sintomo o un biomarcatore ancora non identificato del MA. Ciò è stato confermato quando i ricercatori hanno rilevato un alto livello di ENSA nei topi del modello e nel cervello delle persone con MA.
Che cosa sta facendo esattamente ENSA nel cervello? I test hanno dimostrato che ENSA blocca un canale di potassio nell'ippocampo, una parte del cervello necessaria per generare e richiamare i ricordi.
"Poiché abbiamo ottenuto gli stessi risultati bloccando il canale KATP come accade ai topi senza ENSA", afferma Watamura, "abbiamo ipotizzato che aiutare il canale a restare aperto dovrebbe combattere l'eccesso di ENSA che abbiamo osservato nel MA".
Per testare questa teoria, i ricercatori hanno alimentato i topi modello con diazossido - un farmaco che attiva il canale KATP - e hanno testato la loro memoria. Hanno scoperto che, mentre i topi modello di MA non trattati mostravano la loro memoria caratteristicamente scarsa, quelli trattati hanno avuto prestazioni simili a quelle dei topi normali. Uno sguardo al cervello dei topi trattati ha dimostrato che mancavano le caratteristiche placche di Aβ.
"Le nostre scoperte puntano direttamente a un modo potenziale di prevenire e trattare il MA", afferma Watamura. "Oltre a ciò, rispetto all'immunoterapia che punta l'Aβ, come il farmaco aducanumab, che è stato approvato di recente dalla FDA, gli agonisti sintetici del canale KATP sono meno costosi e sarebbero più accettabili dalle società che invecchiano in tutto il mondo".
Fonte: RIKEN (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Naoto Watamura, Naomasa Kakiya, Per Nilsson, Satoshi Tsubuki, Naoko Kamano, Mika Takahashi, Shoko Hashimoto, Hiroki Sasaguri, Takashi Saito, Takaomi Saido. Somatostatin-evoked Aβ catabolism in the brain: Mechanistic involvement of α-endosulfine-KATP channel pathway. Molecular Psychiatry, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV