Una nuova conquista dei biochimici della University of California Los Angeles (UCLA) ha portato la scienza un passo avanti nello sviluppo di trattamenti che potrebbero ritardare l'insorgenza dell'Alzheimer e prevenire la trasmissione sessuale dell'HIV.
I ricercatori riferiscono di aver progettato degli inibitori molecolari che puntano specifiche proteine associate all'Alzheimer e all'HIV per impedire loro di formare fibre amiloidi, le catene allungate di proteine ad incastro che svolgono un ruolo chiave in più di due dozzine di malattie degenerative e spesso fatali.
"Attraverso lo studio delle strutture di due proteine chiave che formano gli amiloidi, siamo stati in grado di identificare la piccola catena di amminoacidi responsabili della formazione delle fibre amiloidi e progettare un 'tappo molecolare' che si attacca alla fine delle fibre inibendone la crescita" ha dichiarato il leader della ricerca David Eisenberg, direttore del Dipartimento di Energia nell'Istituto di Genomica e Proteomica dell'UCLA e ricercatore del Howard Hughes Medical Institute.
Lo studio è stato pubblicato on-line il 15 giugno sulla rivista Nature e sarà disponibile in una edizione stampa a breve. "Questa ricerca è un primo passo importante verso lo sviluppo di farmaci basati sulla struttura progettata contro le malattie dell'amiloide", ha detto Eisenberg, professore all'UCLA di chimica, biochimica e chimica biologica e membro del California Nanosystems Institute all'UCLA. "I nostri risultati hanno aperto una via in modo che le università e l'industria possano iniziare a creare terapie che non avrebbero potuto essere prodotti 10 anni fa".
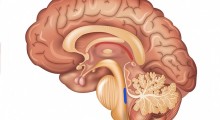
Verso il ritardo dell'Alzheimer - Le fibre amiloidi sono strutture allungate, a tenuta stagna formate da due lastre di proteine legate. Le proteine di ciascun foglio formano catene laterali, incastrate come i denti di una cerniera, ha detto Eisenberg. Le fibre si trovano non solo nell'Alzheimer, ma in una varietà di patologie, tra cui il morbo di Lou Gehrig, il morbo di Parkinson, il diabete di tipo II e una famiglia di disturbi legati al morbo della mucca pazza. Nell'Alzheimer e in altre malattie neurodegenerative, la proteina tau forma fibre amiloidi all'interno delle cellule del cervello, distruggendole attraverso un meccanismo che è ancora oggetto di indagine.
Anche se molte gravi malattie sono caratterizzate da fibre amiloidi, l'Alzheimer è la più diffusa, dice Eisenberg. Oggi ci sono 5 milioni di pazienti negli Stati Uniti che soffrono di Alzheimer, con 500.000 nuovi casi ogni anno. L'assistenza sanitaria all'Alzheimer è costata solo quest'anno circa 178 miliardi dollari, incluso il valore dell'assistenza ai pazienti di Alzheimer, non retribuito, fornita da circa 10 milioni di familiari e amici. "Entro il 2050, si prevede che ci saranno 19 milioni i malati di Alzheimer", ha detto Eisenberg. "La cura di così tanti pazienti con questa malattia debilitante potrebbe diventare una frazione consistente del prodotto interno lordo degli Stati Uniti".
Eisenberg e il suo team di ricerca ha scoperto che l'intera proteina tau, una piccola catena di soli sei aminoacidi (abbreviato in VQIVYK), è responsabile della formazione delle fibre amiloidi. Studiando la struttura delle fibre con l'utilizzo della microcristallografia, un metodo sviluppato all'UCLA per questa ricerca, il team è stato in grado di utilizzare le fibre come modello per progettare un inibitore che potrebbe 'bloccare' la fibra e impedire che cresca.
I risultati sono stati eclatanti. L'introduzione dell'inibitore in una soluzione di proteina tau ha completamente impedito la formazione di fibre amiloidi, convalidando l'idea che è un'opzione plausibile progettare terapie basate sulla struttura, per le malattie amiloidi.
Nonostante questo successo, c'è ancora molta strada da percorrere prima di una terapia valida possa essere sviluppata per combattere l'insorgenza dell'Alzheimer nei pazienti umani, ha detto Eisenberg. L'inibitore, una catena di amminoacidi, è di gran lunga troppo grande per penetrare in profondità nel cervello dove le proteine tau formano le fibre amiloidi. "Questa ricerca è un passo importante verso l'identificazione di molecole più piccole che possono essere utilizzate per sviluppare una terapia", dice Eisenberg. "Il nostro obiettivo è essere in grado di ritardare l'insorgenza della malattia di Alzheimer".
[...]
Gli inibitori della proteina tau e della SEVI sono stati progettati utilizzando amminoacidi sintetici, simili ai blocchi standard che costituiscono le proteine del corpo umano. Ma questi aminoacidi sintetici sono stati capovolti, come visti in uno specchio, o con aggiunta di catene laterali non si trovano normalmente in natura. Gli enzimi nel corpo umano, programmati per spezzare le catene simili alle proteine, sono in linea di principio incapaci di riconoscere gli aminoacidi non naturali, permettendo ai bloccanti di attaccarsi con sicurezza alle proteine bersaglio.
Questa ricerca è stata finanziata a livello federale dai National Institutes of Health, dal National Science Foundation e dal Dipartimento dell'Energia degli Stati Uniti, nonché dall'Howard Hughes Medical Institute e dal Centro unito di Medicina Traslazionale.
Co-autori dello studio: Stuart Sievers e Lin Jiang, ricercatori UCLA post-dottorato; Howard Chang e Anni Zhao laureati UCLA; John Karanicolas, assistente professore alla University of Kansas; Jason Stevens, studente dell'Università del Kansas; David Baker, professore dell'Università di Washington; Professore Jan Münch e ricercatore Onofrio Zirafi, dell'Università di Ulm in Germania.
Piccole molecole, grande lavoro
Un secondo team di ricerca, anch'esso guidato da Eisenberg, ha recentemente annunciato di aver identificato quattro piccole molecole che si legano alle fibre amiloidi, tra cui un candidato promettente chiamato 'orange-G' (G arancio) che si incunea nella fibra tipo cerniera, e può essere in grado di romperla in due parti. Questo studio è stato pubblicato il 14 giugno su PLoS Biology, una rivista online della Public Library of Science.
"Queste sono le prime molecole di piccole dimensioni visualizzate nel momento in cui si legano alle fibre di tipo amiloide", ha detto Eisenberg. "Queste piccole molecole hanno meno probabilità di essere rotte nel corpo e possono potenzialmente essere modificate per forzare la separazione delle fibre amiloidi o servire come strumenti diagnostici per identificare le aree infette del corpo". Eisenberg e il suo team di ricerca hanno scoperto che la orange-G è l'unica molecola in grado di perforare l'impenetrabile "cerniera sterica" che sigilla le fibre amiloidi a tenuta d'acqua della proteina beta-amiloide responsabile della formazione di placche senili nella malattia di Alzheimer. "In 10 anni siamo arrivati al punto in cui si comincia a capire la biologia strutturale delle fibre amiloidi e come inibirle e interferire con loro", ha detto Eisenberg. "Il prossimo passo è quello di produrre materialmente le molecole che inibiscono e rompono le fibre amiloidi - l'obiettivo finale".
Co-autori di questa ricerca UCLA: Kym Faull, professore di psichiatria e scienze biocomportamentali; Jorge Barrio, professore di farmacologia molecolare e medica; i ricercatori Michael Sawaya e Jie Liu, gli studiosi post-dottorato Meytal Landau, Lin Jiang e Sievers Stuart, e lo studente laureato Arthur Laganowsky.
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce?
Puoi usare il modulo dei commenti sotto per dire la tua opinione. Che è importante e unica. Non tenerla per te, non farci perdere l'occasione di conoscerla.
Fonte: Materiale della University of California - Los Angeles. L'articolo originale è stato scritto da Kim DeRose.
Riferimento: Stuart A. Sievers, John Karanicolas, Howard W. Chang, Anni Zhao, Lin Jiang, Onofrio Zirafi, Jason T. Stevens, Jan Münch, David Baker, David Eisenberg. Structure-based design of non-natural amino-acid inhibitors of amyloid fibril formation. Nature, 2011; DOI: 10.1038/nature10154.
Pubblicato in ScienceDaily il 22 giugno 2011 -Traduzione di Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi, eventualmente citati nell'articolo, sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non si propone come terapia o dieta; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer Riese. I siti terzi raggiungibili dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente; in particolare si segnala la presenza frequente di una istituzione medica con base in Germania (xcell-Center) che propone la cura dell'Alzheimer con cellule staminali; la Società Tedesca di Neuroscienze ha più volte messo in guardia da questa proposta il cui effetto non è dimostrato. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione, una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e a informarti: |





 Associazione Alzheimer OdV
Associazione Alzheimer OdV