 Fonte: Lander lab, The Scripps Research Institute.
Fonte: Lander lab, The Scripps Research Institute.
Un team guidato da scienziati dello Scripps Research Institute (TSRI) ha determinato l'organizzazione strutturale di base di un motore molecolare che trasporta carichi e svolge altre funzioni critiche all'interno delle cellule.
Da molto tempo i biologi volevano sapere come funziona questo motore molecolare chiamato "complesso dineina-dinactina". Ma le grandi dimensioni del complesso e la miriade di subunità ed elevata flessibilità hanno finora limitato gli studi strutturali a piccole parti del tutto.
Nella nuova ricerca però, Gabriel C. Lander, biologo del TSRI e il suo laboratorio, in collaborazione con Trina A. Schroer e il suo gruppo della Johns Hopkins University, hanno creato un quadro di tutta la struttura dineina-dinactina.
"Questo lavoro ci dà spunti cruciali della regolazione del motore dineina e stabilisce un quadro strutturale per capire perché i difetti di questo sistema sono collegati a malattie come la corea di Huntington, il Parkinson e l'Alzheimer", ha affermato Lander. Le scoperte sono riferite in Nature Structural & Molecular Biology online dal 9 marzo 2015.
Dettagli senza precedenti
Le proteine dineina e dinactina di norma lavorano insieme su microtubuli per eseguire attività cellulari come la divisione cellulare e il trasporto intracellulare di carichi critici, come i mitocondri e il mRNA. Il complesso ha un ruolo chiave nello sviluppo e nella riparazione neuronale, e sono stati trovati problemi con il sistema motorio dineina-dinactina in malattie del cervello, compreso l'Alzheimer, il Parkinson, l'Huntington e la sclerosi laterale amiotrofica (SLA).
Inoltre, alcuni virus (tra cui l'herpes, la rabbia e l'HIV) sembrano dirottare il sistema di trasporto dineina-dinactina per entrare in profondità nelle cellule. "Capire come interagiscono e lavorano dineina e dinactina, e che aspetto hanno realmente, sicuramente sarà rilevante in termini medici", ha detto Saikat Chowdhury, associato di ricerca, membro del laboratorio di Lander e primo co-autore dello studio.
Per studiare il complesso dineina-dinactina, il laboratorio di Schroer ha prima prodotto proteine singole di dineina e dinactina, che sono esse stesse complesse, con più subunità, ma che si sono conservate così bene nell'evoluzione da essere presenti in forma quasi identica in organismi dal lievito ai mammiferi.
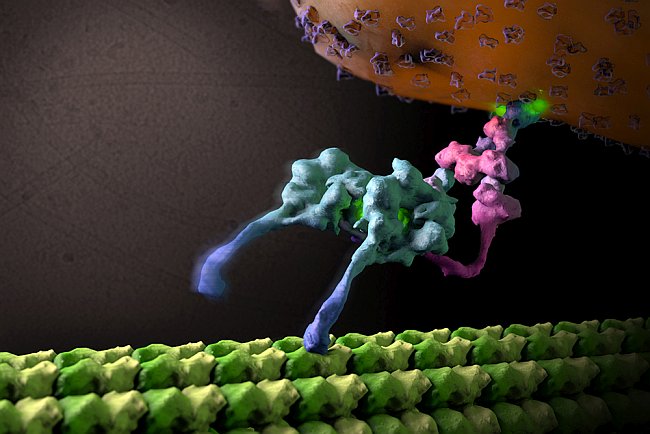
Chowdhury e Lander hanno poi usato la microscopia elettronica (EM) e tecniche di elaborazione delle immagini all'avanguardia, per sviluppare "istantanee" bidimensionali di strutture di base di dineina e di dinactina. Questi dati strutturali contenevano dettagli senza precedenti e hanno rivelato subunità mai osservate prima.
Chowdhury e Lander in seguito hanno sviluppato una nuova strategia per purificare e vedere la dineina e la dinactina in complesso, insieme, su un microtubulo, una struttura simile a un binario ferroviario, onnipresente nelle cellule, lungo la quale la dineina-dinactina sposta i carichi. "Questa è la prima istantanea di come appare tutto il complesso dineina-dinactina e come è orientato sul microtubulo", ha detto Chowdhury.
Superare i limiti
I dati strutturali chiariscono come dineina e dinactina si incastrano in un microtubulo, come reclutano i carichi e come riescono a spostarli sempre in una sola direzione.
Lander e Chowdhury ora sperano di basarsi su questi risultati per produrre un'immagine tridimensionale a maggiore risoluzione del complesso dineina-dinactina-microtubuli, con una tecnica collegata all'EM chiamata tomografia elettronica.
"L'impianto EM al TSRI è il posto migliore al mondo per spingere i limiti della scansione di macchine molecolari complesse come queste", ha detto Lander.
******
L'altro co-autore dello studio è Stephanie A. Ketcham del laboratorio di Schroer. La ricerca è stata finanziata dalla Damon Runyon Cancer Research Foundation, dal programma Pew Scholars, dal programma Searle Scholars e dai National Institutes of Health.
Fonte: Scripps Research Institute (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Saikat Chowdhury, Stephanie A Ketcham, Trina A Schroer, Gabriel C Lander. Structural organization of the dineina–dynactin complex bound to microtubules. Nature Structural & Molecular Biology, 2015; DOI: 10.1038/nsmb.2996
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV